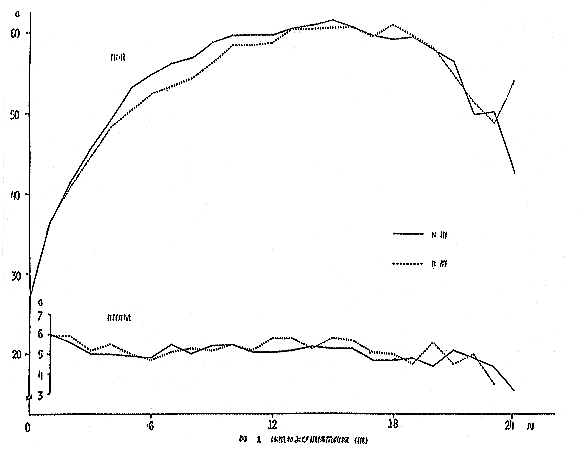
図 1 体重および摂餌量曲線(雄)
 |
γ線照射ウインナーソーセージの安全性を調べる目的で、マウスによる24カ月間の慢性毒性試験を行なったので、その結果について報告する。
実験に用いたウインナーソーセージは、高崎ハム製で、日本原子力研究所高崎研究所において600kradのγ線照射を行った。その後凍結乾燥し、これを検体として5w/w%の割にオリエンタル酵母製マウス飼育用固型飼料(MF)に添加した。
静岡県実験動物農業協同組合産の4週令、雌雄のddY系マウス(SPF)を購入後1週間馴化飼育し、5週齢時に健康と思われるマウスを、雌雄各々1群60匹からなる2群に分け、非照射群(以下N群)および照射群(以下R群)とした。N群には照射を行わなかったウインナーソーセージを添加した固型飼料を、R群には照射したウインナーソーセージを添加した固型飼料をそれぞれ自由に摂取させた。
なお、動物は当所マウス飼育室(温度:23±1℃、湿度:55±5%、照明:12時間明、12時間暗)にて飼育し、プラスチック製マウスケース1個につき2匹づつ収容した。飲水は自動給水装置により水道水を自由に摂取させた。
一般症状および死亡の有無は毎日観察し、実験開始後6ヶ月目までは週1回、12カ月目まで隔週、それ以降24ヶ月目まで月1回の割で体重および摂餌量を測定した。
実験開始後12ヶ月目で各群5匹、24ヶ月目まで生存する全ての動物について、眼窩静脈叢より採血し血液形態学的検査を、また断頭採血し分離した血清を用いて血清生化学的検査を行なった。
血液形態学的検査としては、白血球数(WBC)、赤血球数(RBC)、ヘモグロビン量(Hb),ヘマトクリット値(Ht),平均赤血球容積(MCV)、平均赤血球血色素量(MCH),平均赤血球血色素濃度(MCHC),血小板容積比(Pct)および平均血小板容積(MPV)についてCoulter Counter Model SPを用いて測定し、さらに塗抹標本(ギムザ染色)を作り、白血球百分比を算出した。
血清生化学的検査では、総タンパク量(T−PRO,和光キット)、アルブミン量(ALB,和光キット)、尿素窒素量(BUN,シノテスト)、血糖値(GLU,BMYキット)、トリグリセライド(T−GLY,BMYキット)、アルカリ性ホスファターゼ(ALP,和光キット)、トランスアミナーゼ(GPT,栄研キット)、および乳酸脱水素酵素(LDH,シノテスト)をGemsaec 4型オートアナライザーで、さらにナトリウム(Na)およびカリウム(K)を日立電解質自動分析機702型で測定した。
また12および24ヶ月目に血液検査を行なった動物について、病理解剖を行ない、臓器の重量測定(脳、心臓、肺、肝臓、腎臓、脾臓、副腎、精巣、卵巣)および肉眼的検査を行なった後、10%中性ホルマリン液に固定し、常法に従ってヘマトキシリン−エオシン染色標本を作製し組織学的検査に供した。検査した臓器は、上記の他に下垂体、甲状腺、胸腺、顎下腺、膵臓、胃、小腸、大腸、精巣上体、精嚢、子宮、膀胱、骨髄(大腿骨)、腸間膜リンパ節および脊髄である。
途中死亡動物についても病理解剖を行ない、臓器の肉眼的および組織学的検査を行なった。
各群共に、24ヶ月間にわたり照射によると考えられる症状の発現は見られない。
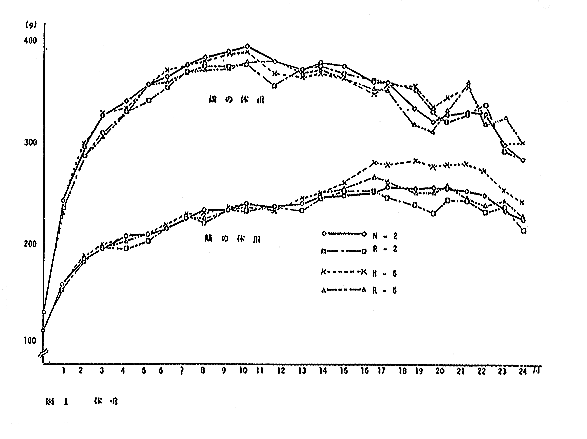
雄では、5ヶ月目から10ヶ月目にかけて、R群にN群と比べて体重増加の軽度の抑制が見られるが、その後特記すべき差は見られない。摂餌量では、4、8、12、13および20ヶ月目でN群に対してR群で有意の増加あるいは減少が認められるが、一定の傾向は見られない。 雌では、11ヶ月目以後R群の体重がN群より高値を示すが、N群との間に有意差は認められない。摂餌量では、2、10および12ヶ月目でR群に有意の増加あるいは減少を認めるが、一定の傾向は見られない。
 |
 |
各群共に、実験開始後9ヶ月目まで散発的に死亡がみられるが、12ヶ月目より死亡数の増加を示す。また雌より雄にやや死亡数が多く認められるが、N群とR群の間に差は見られない。
イ)12ヶ月目:雄の白血球数および白血球百分比の分葉核好中球、リンパ球および単球に有意の変化が見られるが、雌では差は認められない。
ロ)24ヶ月目:雄のR群において、赤血球数、Hb,Htおよび単球がN群に比べ有意な減少を示す。雌ではHt,MCH,MCHCにN群に比べ有意な減少あるいは増加を認める。
イ)12ヶ月目:雄のR群でNaがN群に比べ有意な減少を示すが、雌では差を認めない。
ロ)24ヶ月目:雄のR群で血糖値がN群に比べ有意な増加を、また雌ではNaがR群で有意な減少を示す。
12ヶ月目では雌のR群で、脳の実重量に有意の増加を認めるが、他には比重量を含め変化は見られない。
24ヶ月目では雄のR群で副腎の比重量がN群に比べ有意の減少を示すが、実重量では差は見られない。
なお、実重量と比重量が共に差を示す臓器は両時期を通して認められない。
12ヶ月目:各群の主な変化は、肺および皮膚に認められる。雄では、肺の腫瘤がN群で3例、R群で2例みられる。皮膚の腫瘤がN群に1例みられる。雌では、肺の腫瘍がN及びR群に各1例見られる。
24ヶ月目:腫瘤の形成は、肺に最も多く、雄のN群で5例、R群で4例、雌のN群で2例、R群で6例みられる。その他の臓器では、雄のN群の1例に心臓表面の白変化がみられ、肝では雄のN群の3例、R群の1例、雌ではN群の3例に腫瘤を認める。また皮膚では、潰瘍を伴う結節性変化が雌のN群およびR群に各々1例見られ、リンパ節の腫大が雌のN群で3例、R群で4例にみられる。
途中死亡動物(表7):途中死亡動物に認められた変化の主なものを表に示した。これらのうち最も発生頻度の高いものは肺の腫瘤で雄のN群では31/49例、R群では37/51例、雌のN群25/48例、R群24/44例であった。これらの結節はいずれも乳白色の硬度感を有するものである。
脾臓およびリンパ節の腫大が、肺の腫瘤に次いで多く見られる。また皮下の腫瘤が雄ではN群3例、R群2例に認められるのに対して、雌ではN群13例、R群14例と雌に多く見られる。これらの結節は、乳白色調で剥離性がよく、またこれらの結節の中には嚢胞を形成するものもある。
肝臓、腎臓、精巣、卵巣および子宮で少数例に結節あるいは血腫および嚢胞の形成が認められる。
12ヶ月目(表8):肺の腺腫を雄のN群で3例、R群で2例、また雌ではN群およびR群で各1例認める。その他雄のN群の1例に皮膚の乳頭腫を認める。腫瘍発現動物数は雄のN群で3/5例(60.0%)、R群2/5例(40.0%)、また雌ではN群およびR群共に1/5例(20%)である。
24ヶ月目(表9):雄、雌共に各群肺の腺腫が多い。また雄、雌共にN群で肝臓の結節性増殖を認める。その他に心臓、副腎、乳腺などの腫瘤あるいは白血病を散見する。腫瘍発現動物数は、雄のN群6/6例(100%)、R群4/4例(100%)、また雌のN群は4/7例(57.1%)、R群8/11例(72.7%)で、雄、雌いずれも群間に差を認めない。
途中死亡動物(表10、表11):雄、雌共に肺の腺腫および白血病が、雄では肝臓の結節性増殖が、また雌では乳腺腫瘍の発生が多数認められる。その他の腫瘍の発生部位は、雄で腎臓、脾臓、膵臓、精巣、前立腺、リンパ節、皮下組織および小腸、また雌では肝臓、卵巣、副腎、リンパ節、皮膚および皮下組織などであるが、いずれも散発的である。これらの腫瘍の発現数は、雄、雌共に群間に有意差を認めない。
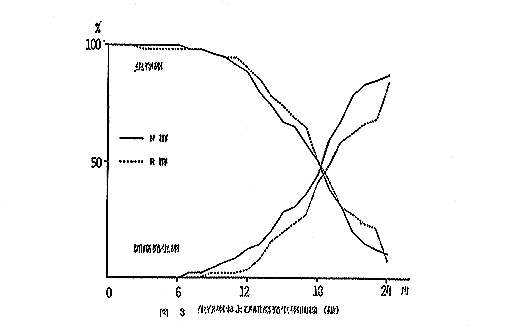
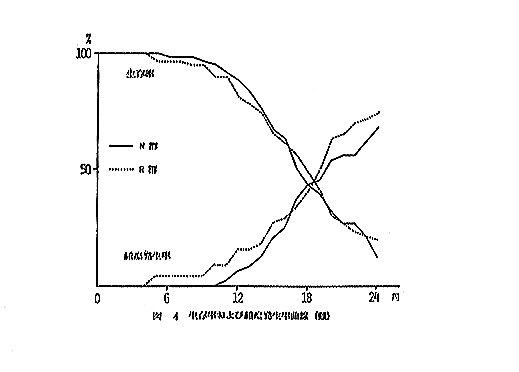
途中死亡動物の腫瘍発現時期は第3図および第4図に示すように、雄ではN群で7ヶ月目、R群で9ヶ月目であった。また雌ではN群で11ヶ月目、R群で5ヶ月目であった。
腫瘍発現動物数は、雄ではN群で43/49例(87.8%)、R群で43/51例(84.3%)、また雌ではN群33/48例(68.8%)、R群33/44例(75.0%)で、雄、雌共に群間に差は認められない。
 |
 |
γ線照射ウインナーソーセージの安全性を調べる目的でマウスによる24ヶ月間の慢性毒性試験を行なった。
1.一般症状、体重、摂餌量および死亡率では24ヶ月間にわたってN群とR群との間に明らかな差は認められなかった。
2.12ヶ月目および24ヶ月目の血液形態学的検査および血清生化学的検査では、24ヶ月目で、雄のR群の赤血球数、HbおよびHtがN群に比べ有意の減少を示すが、これはN群の数値が増加したためで、R群の数値は正常範囲内と考えられる。しかしこれ以外に若干の差が認められたが、明らかな傾向が認められず、毒性上意味のある変化とは思われない。
3.12ヶ月目および24ヶ月目の病理学的検査では、その臓器重量および腫瘍発現数(率)には、雄、雌共に群間に差は認められなかった。同様に途中死亡動物の検査結果でも腫瘍発現数に差は認められなかった。
以上のことから、γ線照射ウインナーソーセージをマウスに投与しても、照射によると考えられる影響はないものと考えられる。
γ線照射ウインナーソーセージの安全性を調べる目的で、ラットによる24ヶ月間の慢性毒性試験を行ったので、その結果について報告する。
科学技術庁食品照射研究運営会議指定の高崎ハム製ウインナーソーセージを必要に応じて作製し、これを二分して、一方を非照射ウインナーソーセージとし、他方を日本原子力研究所高崎研究所において600kradのγ線照射を行い照射ウインナーソーセージとし、これらを薄片状に切断し凍結乾燥した。この時の歩止まりは37.5%であった。この乾燥ウインナーソーセージを粉砕し、ラット用粉末飼料(オリエンタル酵母製、MF)に2W/W%及び5W/W%の割合に混合し、円柱型ペレットに成型して検体飼料とした。これらの飼料を24ヶ月間に亘り自由に動物に与えた。
静岡県実験動物農業協同組合産の生後4週令の雄雌のウィスター系ラットを購入後1週間馴化飼育し、5週令時に健康と思われるラットを、雄雌各々1群30匹からなる4群に分け、非照射群(2%:N−2,5%:N−5)及び照射群(2%:R−2,5%:R−5)とした。
なお、動物は当所ラット飼育室(温度:25±1℃、湿度55±5%、照明:12時間明、12時間暗、100%新鮮空気調和)にて各々個別ケージで飼育し、飲水は自動給水装置により水道水を自由に摂取させた。
一般症状及び死亡の有無については毎日観察し、体重及び摂餌量は実験開始後3ヶ月目までは週1回、12ヶ月目までは隔週、18ヶ月目までは3週に1回、それ以降24ヶ月目まで月1回の割合で測定した。
実験開始後6、12及び18ヶ月目に各群5匹、24ヶ月目に生存する全動物について、尾静脈より採血し血液形態学検査を、また断頭採血し分離した血清を用いて血清生化学的検査を行い、更に病理組織学的検査を実施した。
途中自然死亡した動物は発見後可及的速やかに解剖し、肉眼所見を記録した後組織学的検査に供した。なお、死亡率の計算はlife−table techniqueを用いて行った。
また、上記の各時期に行った血液の形態学的及び生化学的検査と病理学的検査の内容は次の通りである。
血液形態学的検査
赤血球及び白血球数(RBC,WBC):トーアミクロセル
カウンター
ヘモグロビン量(Hb):シアンメトヘモグロビン法
ヘマトクリット値(Ht):毛細管遠心法
白血球像(百分比):塗抹標本
血清生化学的検査
総蛋白量(Protein):ピュレット法
アルブミン(Albumin):HABC色素結合法
コレステロール(T−Chol.,F−Chol.):Zakの
変法
アルカリ性ホスファターゼ(ALP):Kind and
King法
トランスアミナーゼ(GOT,GPT):Reitman−
Frankel法
尿素窒素(U−N):飴野・亀岡のジアチルモノオキシム
直接比色法
遊離脂肪酸(NEFA):パソコプロイン比色法
トリグリセライド(Trigyceride):Fleteher
の方法
無機リン(S−Pi):サフラニン法
臓器重量の測定:脳、下垂体、甲状腺、心臓、肺、肝臓、
腎臓、副腎、脾臓、精巣及び卵巣
病理学的検査
肉眼的検査:体表面の形状及び臓器・組織の肉眼的検査
組織学的検査:上記の諸臓器のほかに胃、小腸、膵臓、骨髄、
及び腸間膜リンパ節の光学顕微鏡による検査
実験結果の統計的有意性は、Student’s t−testにより同一添加量の非照射群と照射群の群間で検討した。
24ヶ月までの飼育全期間を通じて、雄雌各群ともに特記すべき症状の発現を見ない。
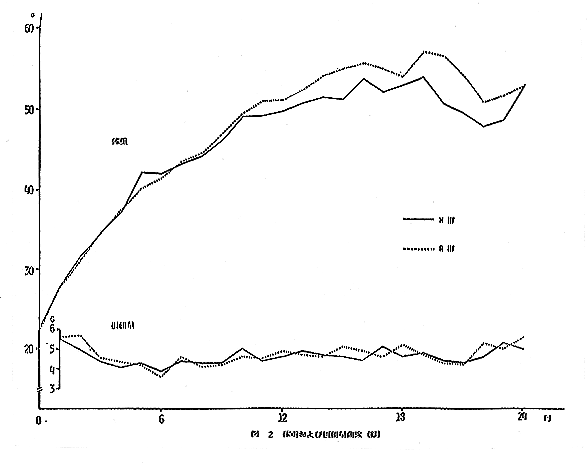
雄雌ともに実験開始後70週目頃まで殆んど差を認めないが、その後雄ではR−5群が80週目から90週目にかけて一時的に体重増加の抑制及び増加を示す。雌では、N−5群が70週目以降R−5群に比べ増加の傾向を示す。
 |
雄雌ともに全期間を通じて、群間に殆んど差を見ない。
 |
雄では、R−2群がN−2群に比べやや高値を示し、R−5群がN−5群に比べ逆にやや低値を示すが、いずれも有意差を見ない。雌では、R−2群がN−2群に比べやや高値を示すが有意差を見ない。また、R−5群及びN−5群の群間に殆んど差を認めない。
6ヶ月目(表2):雄では、R−2群でHt値がN−2群に比べ、また、雌では、R−5群でHt値がN−5群に比べ、いずれも有意の減少を示す。
12ヶ月目(表2):雄では、R−5群でRBCがN−5群に比べ有意の減少を示し、WBCが減少の傾向を示すが有意差を見ない。雌では、R−2群でHt値がN−2群に比べ有意の増加を示す。
18ヶ月目(表3):雄では、R−5群のHt値がN−5群に比べ有意の減少を示す外は、各項目で群間に殆んど差を見ない。また雌についても殆んど群間に差を認めない。
24ヶ月目(表3):雄雌ともに群間に差を認めない。
上述のように、6、12、18及び24ヶ月目の各時期において、白血球百分比を含め同一添加量の非照射群及び照射群の群間に一定の傾向を見ない。
6ヶ月目(表5):雄では、R−2群でChol.%がN−2群に比べて有意の増加を示し、GOTが有意の減少を示す。雌では、R−2群でS−PiがN−2群に比べ有意の増加を示すが、他の項目では殆んど群間に差を見ない。
12ヶ月目(表5):雄では群間に殆んど差を見ない。雌では、R−2群でF−Chol.がN−2群に比べ有意の減少を示し、Chol.%が有意の増加を示す。
18ヶ月目(表6):雄では、R−2群でU−NがN−2群に比べ有意の増加を、また、R−5群でAlbuminがN−5群に比べ有意の増加を、U−Nが逆に有意の減少を示す。雌では、R−2群でProteinがN−2群に比べ有意の減少を示し、S−Piが有意の増加を示す。
またR−5群でAlbumin,GPT及びTriglycerideがいずれのN−5群に比べて有意の減少を示す。
24ヶ月目(表6):雄では群間で殆んど差を見ない。雌では、R−5群でNEFAがN−5群に比べ有意の減少を示す外は殆んど差を認めない。
上述のように6、12、18及び24ヶ月目の各時期で群間にいくつかの差を見るが、同一添加量の非照射群及び照射群の群間で一定の傾向を見ない。
6、12、18及び24ヶ月目の各時期に解剖した動物の臓器実測値及び体重比がともに同一方向に差を示すものについて述べる。
6ヶ月目(表7):雄では、R−2群で心臓がN−2群に比べ有意の減少を示す。雌では、R−5群で脳がN−5群に比べ増加の傾向を示す。
12ヶ月目(表8):雄ではともに同一方向に差を示す臓器を見ない。雌ではR−5群で副腎がN−5群で副腎がN−5群に比べ減少の傾向を示す。
18ヶ月目(表9):雄では、R−2群で脳及び副腎がN−2群に比べいずれも減少の傾向を、肺が増加の傾向を示す。雌では、R−2群で脳がN−2群に比べ減少の傾向を示し、R−5群で下垂体、甲状腺及び副腎がN−5群に比べいずれも有意の増加ないしその傾向を示す。
24ヶ月目(表10):雄では、R−2群で副腎、脾臓及び精巣がN−2群に比べいずれも減少の傾向を示す。雌はともに同一方向に差を示す臓器を見ない。
上述のように、6、12、18及び24ヶ月目の各時期でいくつかの差を見るが、同一添加量の非照射群及び照射群の群間で一定の傾向を認めない。
6ヶ月目:雄雌ともに各群で変化を認めない。
12ヶ月目:雄では主な変化として肺炎が各群で1〜4例認められる外、N−5群で肺と胸膜の癒着が2例認められる。雌ではN−2群を除く各群で肺と胸膜の癒着が1〜3例認められる。
18ヶ月目:雄では、肺炎が殆んどの動物に認められる外、肺膿瘍あるいは肺と胸膜の癒着が並存する動物も少数例認められる。また腎臓では表面の粗ぞう化が各群1〜3例認められる。精巣では片側性の萎縮あるいは白色腫瘍が、各群の殆んどの動物にみられる。雌では、肺炎を各群に2〜3例、また肺膿瘍の並存するものが各群に1〜2例認められる。その外、肝臓の退色、腎臓の表面粗ぞう化、子宮蓄膿及び卵巣の嚢腫形成(卵巣実質と包膜の間に漿液様物貯留)などの変化を散発的に認める。
24ヶ月目:雄では、肺炎がN−2群及びR−2群で認められる外、腎臓で表面の粗ぞう化、精巣の白色腫瘍が各群の殆んどの動物に見られる。雌では、肺炎及び肺膿瘍形成がN−2群及びR−5群でみられる外、腎臓で表面の粗ぞう化を認める。
また、肝臓の褪色及び肥大、脾臓の腫大、子宮蓄膿、下垂体血腫、卵巣の嚢腫形成及び皮下組織の腫瘤形成などの変化を散発的に認める。
自然死動物の剖検所見:飼育期間中に自然死した動物の剖検所見は、雄雌ともに主な変化として肺の膿瘍及び充うっ血が各群でそれぞれ2〜8例を認める。
上述のように6、12、18及び24ヶ月目の定期解剖及び自然死解剖例の肉眼的所見には、雄雌ともに非照射群と照射群の群間に著しい差は認められない。
6、12、18及び24ヶ月目の定期解剖及び自然死解剖した組織学的検査の結果、腫瘍については腫瘍の項で述べる。
6ヶ月目(表11):主な変化としては雄雌ともに肺で肺胞壁の肥厚、肝臓でグリソン鞘内円形細胞浸潤、星細胞の肥大、腎臓で細尿管内上皮性円柱の出現を見る。しかし、これらの変化は非照射群と照射群の群間に差を見ない。
12ヶ月目(表12):主な変化は雄雌ともに肺で肺胞壁肥厚、腎臓で細尿管内上皮性円柱あるいは硝子様円柱などである。これらの変化は群間にほとんど差を見ない。
18ヶ月目(表13):雄雌の主な変化は肝臓でグリソン鞘内円形細胞浸潤、腎臓で慢性の糸球体基底膜肥厚、尿細管内上皮性円柱、硝子様円柱、尿細管の拡張、硝子滴変性及び間質の増殖など、いわゆる慢性腎症の像を認める。その外、精巣では間質細胞の増殖を認める。これらの変化には群間に差を見ない。
24ヶ月目(表14):雄雌ともに甲状腺、心臓、肺、肝臓、腎臓、脾臓、副腎及び生殖器(精巣・卵巣)などに変化が見られる。それらの主な変化としては、肺で肺胞壁肥厚、気管支肺炎など、いわゆる肺炎像を呈するものを多く認める。腎臓では慢性の糸球体の基底膜肥厚、尿細管内の上皮性円柱、硝子様円柱、尿細管拡張、間質の増殖及び円形細胞の浸潤など、いわゆる慢性腎症の像を呈するものを見る。これらの変化は雄雌ともに群間に一定の傾向を見ない。
また、この外の臓器における変化は散発的であり、群間に差を見ない。
上述のように6、12、18及び24ヶ月目の各時期での組織学的検査の結果、各時期の雄雌とともに変化をもった動物数及び変化の内容にも、非照射群と照射群の群間に差は認められない。
自然死動物(表15):雄では、下垂体の色素嫌性腺腫、副腎のクローム親和性細胞腫及び精巣の間質細胞腫などの出現が多く見られるが、群間に一定の傾向を見ない。雌では、下垂体の色素嫌性腺腫、副腎のクローム親和性細胞腫などの発現を見る。なお、R−2群の1例に皮下織の繊維腺癌が肺、肝臓、腎臓への転移像を認める。雌の腫瘍の発現数あるいはその内容について見ると雄と同様に群間に差を認めない。
自然死動物及び定期解剖動物(表16):6、12、18及び24ヶ月目に定期的に解剖した動物と自然死動物の腫瘍発現については、検査対象動物として雄ではN−2群、R−2群、N−5群及びR−5群でそれぞれ27、29、28及び26例、雌ではそれぞれ27、27、30及び29例である。なお、雄のN−2群、R−2群、N−5群及びR−5群でそれぞれ3、1、2及び4例、雌のN−2群及びR−2群の各々3例とR−5群の1例は、死後変化が強く検査不能であった。
雄で最も腫瘍発現が多く認められる臓器は精巣でありN−2群、R−2群、N−5群及びR−5群でそれぞれ9、7、8及び8例である。
次いで副腎のクローム親和性細胞腫が各群それぞれ2、3、4及び2例に見られる。その外、下垂体で色素嫌性腺腫がN−2群で2例、R−2群及びN−5群で各々1例ずつ、また甲状腺の腺腫がN−5群で1例に認められる。
雌では、副腎でクローム親和性細胞腫がN−2群、R−2群及びN−5群でそれぞれ3、1及び2例に、次いで下垂体の色素嫌性腺腫がN−2群、R−2群及びR−5群で各々1例ずつ、N−5群で2例に認められる。その外の臓器では甲状腺の偏平上皮癌がN−2群及びR−2群で各々1例、脾臓のリンパ腫がN−5群で1例、胃の繊維肉腫がR−5群で1例に認められる。また、皮下織及び乳腺では嚢腺腫がN−5群で1例、腺癌がN−2群及びN−5群で各1例、繊維腫がN−5群で2例に、繊維腺癌及びリンパ組織のリンパ腫がR−2群でそれぞれ1例ずつ認められる。これらの腫瘍発現動物数は、雄ではN−2群、R−2群、N−5群及びR−5群でそれぞれ11、9、9及び8例であり、雌ではそれぞれ4、5、8および2例である。
上述のように腫瘍の組織学的検査の結果、雄雌ともに腫瘍の発現数、発現部位あるいは組織学的検査で一定の傾向は認められず、かつ群間に明らかな差は認められない。
γ線照射ウインナーソーセージの安全性を調べる目的でラットによる24ヶ月間の慢性毒性試験を行った。
一般症状、摂餌量及び死亡率では、雄雌ともに24ヶ月間に亘って同一添加量による非照射群と照射群の間に明らかな差は認められないが、雌の成長曲線で70週目以降N−5群がR−5群に比べやや増加の傾向を示す。また、定期的に行った血液形態学的検査及び血清生化学的検査の各時期で若干の有意差を示す項目を認めるが、雄雌ともに同一添加量の非照射群と照射群の間に明らかな傾向は認められない。また、病理学的検査では、その臓器重量及び腫瘍発現数にも雄雌ともに明らかな差は認められない。なお、途中自然死動物の検査でも腫瘍発現数に差は認められない。
以上、γ線照射ウインナーソーセージをラットに投与しても、今回の条件下では照射によると見なされる影響は認められない。
γ線照射ウインナーソーセージの安全性を調べる目的で、サルによる24ヶ月間の慢性毒性試験を行ったので、その結果について報告する。
実験に用いたウインナーソーセージは、高崎ハム製で、日本原子力研究所高崎研究所において600kradのγ線照射を行った。その後凍結乾燥し、これを検体として5w/w%の割に船橋農場製サル飼育用固型飼料に添加した。
静岡県実験動物農業協同組合より、検疫ずみのインド産アカゲザルを購入し、サル飼育室(温度:23±1℃、湿度:55±5%、照明:12時間明、12時間暗)にて実験開始まで馴化飼育した。
健康と思われるアカゲザル雄雌各6頭(計12頭)を1群3頭からなる2群に分け、1群には照射を行わなかったウインナーソーセージ(N群)、他の1群には照射ウインナーソーセージ(R群)を添加した飼料を与えた。給餌は毎日午前11時に固型飼料を1頭当たり150g与えた。さらに週2回ビタミンCを1回50mgチョコレートに添加して与えた。飲水は自動給水装置により自由に摂取させた。
一般症状は毎日給餌前に観察し、体重測定は月1回行った。
実験開始前および実験開始後3、6、9、12、15、18、21および24ヶ月間目に、伏在静脈より採血し、血液形態学的検査および血清生化学的検査を行った。
血液形態学的検査としては、白血球数(WBC),赤血球数(RBC),ヘモグロビン量(Hb),ヘマトクリット値(Ht)、平均赤血球容積(MCB),平均赤血球色素量(MCH),平均赤血球血色素濃度(MCHC),血小板数(PLT),血小板容積比(Pct)および平均血小板容積(MPV)についてCoulter Counter model SPを用いて測定した。さらに塗抹標本(ギムザ染色)を作成して白血球百分比を数えた。血清生化学的検査では、採血後分離した血清についてGemsaec4型オートアナライザーを用いて、総タンパク量(T−PRO,和光キット )、アルブミン量(ALB、和光キット)、尿素窒素(BUN,シノテスト)、クレアチニン(CRN,BMYキット)、血糖値(GLU,BMYキット)、リン脂質(PI,和光キット)、トリグリセライド(T−GLY,BMYキット)、総コレステロール(T−CHO,BMYキット)、アルカリ性ホスファターゼ(ALP、和光キット)、コリンエステラーゼ(CH−E,BMYキット)、クレアチンキナーゼ(CK,BMYキット)、トランスアミナーゼ(GOT,GPT,栄研キット)、γ−グルタミールトランスペプチターゼ(γ−GTP,BMYキット)、α−ハイドロキシブチレイトデハイドロゲナーゼ(HBDH,BMYキット)、乳酸脱水素酵素(LDH−P,シノテスト)、さらに電解質としてカルシウム(Ca、和光キット)、無機リン(Pi、和光キット)およびマグネシウム(Mg,和光キット)を、また日立電解質自動分析機702型でナトリウム(Na),カリウム(K)およびクロール(Cl)を測定した。
実験終了時の24ヶ月目に塩酸ケタミン麻酔下で頸動脈より放血致死させ、病理解剖を行った。各摘出臓器の肉眼的観察を行い、臓器重量を測定した(脳、心臓、肺、肝臓、腎臓、脾臓、精巣、卵巣、下垂体、甲状腺、副腎)。臓器は10%中性ホルマリン液に固定した後、常法に従ってH−E染色を施し、組織学的検査に供した。検査した臓器は、上記の他に、顎下腺、胸腺、舌、食道、胃、小腸、大腸、膵臓、精巣上体、精嚢、前立腺 、子宮、膀胱、骨髄(大腿骨)、脊髄、末梢神経(座骨神経)、リンパ節、皮膚および筋肉(大腿部)である。
9ヶ月目に死亡した雌のN群の1頭(N−3)および18ヶ月目に死亡した雄のN群の1頭(N−2)を除いて、他の10頭には時々下痢症状を認めたが、群間に差はみられなかった。
18ヶ月目に死亡した雄の1頭(N−2)は、17ヶ月目頃より食欲減退、尿糖(ブドウ糖試験紙陽性)などの症状と共に左前後肢に麻痺症状を呈し、次第に痩削と軽度の貧血症状を認めるに至った。発症後3週間頃より全身性の痙攣をおこした。痙攣は間欠的で呼吸困難を伴っており後弓反張を呈した。そして発症後1.5ヶ月で死亡した。
9ヶ月目に死亡した雌の1頭(N−3)は8ヶ月目頃より食欲減退、下痢などの症状が続き、9ヶ月目に痩削、貧血、食欲廃絶などの症状がみられ死亡した。
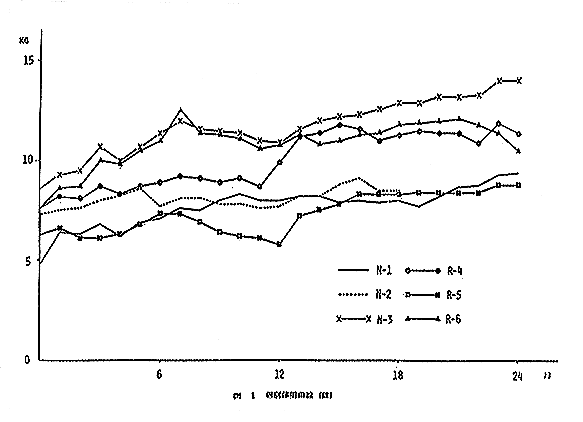
イ)雄(図1):N−1は投与開始後から、10ヶ月目までと20ヶ月目にゆるやかな増加がみられた。N−2は、前述の症状が発現するまで著明な増減を示さなかった。しかし発症後著明な減少がみられ、死亡時の体重は4.45kgであった。N−3は実験期間中増加を続けた。
R群ではR−6が22ヶ月目より減少する傾向を示したが、他の2頭は実験期間中増加を認めた。
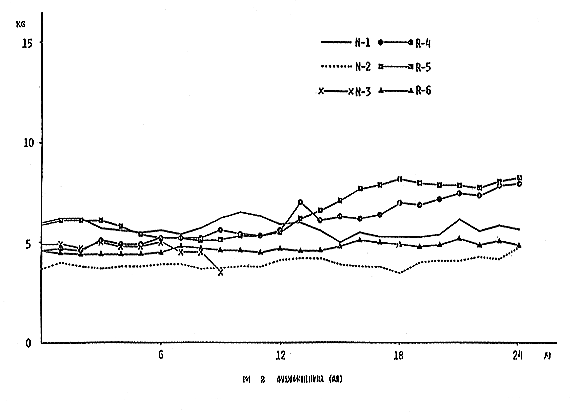
ロ)雌(図2):N−1とN−2は実験期間中著明な増減を示さなかった。死亡したN−3は、6ヶ月目以後減少を示し、死亡時の体重は3.45kgであった。
R群ではR−6は実験期間中体重の横這いを示し増減はみられなかったが、R−4およびR−5は13ヶ月目頃より増加を示した。
 |
 |
雄のR群の白血球数が6ヶ月目でN群に比べ増加する傾向を示すが有意差は認められない。またRBC,Hb,Htが6ヶ月目の雌のR群で有意な増加を示す。
9ヶ月目で、雄のR群でWBCの増加が認められる。
また18および21ヶ月目で雄のR群のPLTおよび雌のR群のMCHCに有意の増加が認められる。
白血球百分比では、15ヶ月目で雄のR群が単球が有意に増加する以外、雄雌共にN群と比べR群に有意の差はみられない。
3ヶ月目で、雄のN群にT−PRO,ALB,CK,γ−GTP,Ca,PiおよびNaに有意の増加あるいは減少が認められるが、雌では有意差は認められない。
9ヶ月目では、雌のR群でKの増加が認められるが、投与前の値と比べると異常値とは考えられない。
12ヶ月目では、雄のN群のT−PROおよびNa、また雌のR群のCKおよびPiが有意の減少を示す。
15ヶ月目では雌のR群にGOTおよびClの低下または増加が認められる。
18ヶ月目以降では、21ヶ月目に雌のR群のT−GLYに増加が認められる。
以上、血清生化学的検査では、各時期で有意差を認める項目があるが、全期間を通して一定の傾向を呈するものは認められない。
(i)臓器重量(表13):臓器重量では、実重量および比重量で、雌雄共にN群およびR群の間で有意差を示す臓器は認められなかった。
(ii)肉眼所見:雄のN群で1例(N−1)に肺の炭粉沈着を、他の1例(N−3)では肺表面に白色の隆起が見られ、割面で気管支壁の肥厚を認める。
雌では、N群で2例(N−1,N−2)に肺の炭粉沈着を認め、その内1例(N−1)では肺の膿瘍の形成と胸膜との癒着を見ると共に、胸腔内に約10mlの乳白色調胸水の貯留を認める。
上記の他には、肉眼的にほとんど変化は認められない。
(iii)組織学的所見(表14):表に示すような変化がみられるが、その発生数には群間には差は認められない。
(i)肉眼所見
雄のN群(N−2):外見上、痩削、可視粘膜の蒼白化が見られ、左右腋下および鼠径部に皮下の浮腫を認める。臓器では左右大脳前頭葉髄質部に出血巣が見られ、さらに第3脳室の拡張を認める。また肺の炭粉沈着および心嚢液の著明な貯留を認めるが、他の臓器にはほとんど変化を見ない。
雌のN群(N−3):外見上痩削と眼瞼の浮腫を認め、腹部皮下組織は一部ゼラチン様を呈する。心臓は肥大し、冠状動静脈周囲に点状あるいは斑状の出血巣を認める。その他に肺の炭粉沈着、腸間膜リンパ節の腫大を見る。
(ii)組織学的所見
雌のN群(N−2):大脳髄質で著明な出血巣がみられ、その周囲の神経膠細胞は、腫大、増殖し、貪食像(ヘモジデリン)も認められる。出血巣周囲の脳実質は空胞化を呈す。しかし小脳には変化を認めない。
他に肺の炭粉沈着、肝細胞の膨化および腎のうっ血を見る。
雌のN群(N−3):大脳皮質に血管の栓塞、神経膠細胞の増殖、偽神経食現象および軽度の出血がみられる。心臓では冠状動脈の梗塞および心筋内出血、円形細胞の浸潤、心筋の膨化を認める。肺では気管支内に喀痰様物がみられ、肺胞内には、泡末細胞の浸潤および炭粉沈着を見る。肝では肝細胞の空胞化および大小不同、多核細胞の増加、類洞の拡張をみる。そのほか、副腎皮質の出血、髄質の石灰沈着を見る。
γ−照射ウインナーソーセージの安全性を調べる目的で、アカゲザルを用いた24ヶ月間の慢性毒性試験を行った。
a)一般症状および体重では、実験期間中、雄および雌のN群に死亡が各1例みられたが、それ以外は雌雄ともに変化は認められなかった。
b)投与開始前および開始後の血液形態学的検査および血清生化学的検査では、雄、雌ともにR群でN群と比べ有意の増加あるいは減少を示すものが散見されるが、経時的にみると一定の傾向は認められないことから、いずれも一過性のものと考えられる。
c)実験終了時の24ヶ月目の病理学的検査でも照射によると思われる病変は認められなかった。
d)途中死亡の死因は、雄のN群の1例(N−2)では脳内出血、また雌のN群の1例(N−3)は心臓冠状動脈の梗塞と診断された。
以上の結果からγ線照射ウインナーソーセージをアカゲザルに投与しても今回の実験条件下では照射によると思われる影響はないものと考えられる。
γ線照射ウインナーソーセージの安全性に関する研究の一環として、マウスによる世代試験を行ない、各世代における繁殖生理値および催奇形性への影響を検索した。
検体は、非照射(0krad)および照射(600krad)ウインナーソーセージを使用した。ウインナーソーセージ(以下ソーセージと略)は科学技術庁食品照射研究運営会議指定のものを用いた。
飼料調製は、検体のソーセージを薄くスライスして凍結乾燥した後(歩止り37.5%)、粉砕し、マウス飼育用粉末飼料(オリエンタル酵母K.K)に5w/w%添加し、固型飼料を作製した。また、対照としてはマウス飼育用固型飼料(オリエンタル酵母K.K)を用いた。
ddY系マウス(静岡実験動物農業協同組合)を用いた。マウスは4週令で購入し、1週間馴化飼育(温度25±1℃、湿度50±5%、12時間人工照明)後、実験に供した。
馴化飼育後、健康と見られる動物を選定し、親世代(以下P世代と略)動物として雄雌各々50匹からなる対照群、非照射群および照射群の3群とした。3群に分けた動物は、図1に示す全期間、対照群には飼育用飼料を、非照射群には非照射ソーセージ添加飼料を、照射群には照射ソーセージ添加飼料を自由に摂取させた。
P世代の動物は図1に示すように、それぞれの飼料を28日間摂取させた後、雄:雌=1:1で3日間、午後5時より翌日の午前9時まで同居させ交配を行なった。なお、同居翌朝、膣栓を確認した雌動物は妊娠動物とみなし、この日を妊娠0日とした。妊娠動物は2分し、1群は妊娠18日目に末期胎仔検査のために剖検した。他の1群は第1世代(以下F1世代と略)動物を自然分娩させた。F1世代動物は離乳時(生後21日令)で3分し、1群は生後21日令で新生仔の検査を、1群は第2世代(以下F2世代と略)動物を得るために5週間飼育々成後、交配させた。残りの1群は慢性毒性試験の動物に供した。その後は図1に示すごとく第3世代(以下F3世代と略)まで実験を行なった。
なお、F1およびF2世代での交配期間は4日間とした。
 |
一般症状は外見上の変化を毎日観察した。体重測定は、哺乳期(0〜3週令)の新生仔では1腹ごとにまとめて、4週令より交配時までの期間は個々に、それぞれ週1回測定した。妊娠動物は妊娠0日より18日目まで毎日測定し、妊娠0日を基として体重の増加量を求めた。
繁殖生理値の指標として
交配率=(交配を認めた雌数/交配に使用した雌数)×100
妊娠率=(妊娠動物数/交配を認めた動物数)×100
平均同腹仔数=自然分娩した動物の同腹仔数
哺育率=(離乳母獣数/分娩母獣数)×100
離乳率=(総離乳仔数/総出産仔数)×100
について検索した。
妊娠18日目の母獣を帝王切開し、胎仔の生存の有無を検索した。更に、生存胎仔は個別に体重測定、口腔内を含む外形検査および発育遅延胎仔(体重1g以下)を検査した。死亡胎仔は状態により浸軟胎仔、胎盤遺残および着床痕跡の3種に分類した。なお、着床数は生存胎仔数と死亡胎仔数の合計で表わした。
新生仔(生後21日令)の動物について、肝臓、腎臓および精巣(卵巣)の肉眼的変化を観察した後、重量の測定を行なった。またそれぞれについて100g体重比を算出した。
末期胎仔および新生仔は屠殺解剖後アルコール固定し、Dawson法に従いアリザリンレッドS染色を施して骨格の透明標本を作製し、骨格の異常ならびに化骨の進行状態を検査した。
P世代動物の内、F1世代の親動物として用いた仔を分娩した動物(雄雌)について、後に述べる理由により骨格染色を行ない腰椎の仙椎化について検査した。
各測定値の推計処理は、0〜9週令(交配時)までの動物および妊娠動物の体重、平均着床数、同腹仔数および化骨進行度(仙椎+尾椎数)はt検定、胎仔体重および臓器重量はWeilのWeighting Factorを用いたt検定、交配率、妊娠率、哺育率、離乳率およびP世代親動物の骨格検査成績(腰椎の仙椎化)はχ・E(2)検定、外形異常胎仔数、死亡胎仔数および胎仔ならびに新生仔の骨格検査成績はWilcoxonの順位和検定を行なった。
なお、これらの検定は対照群と非照射群および照射群、非照射群と照射群の群間で行なった。
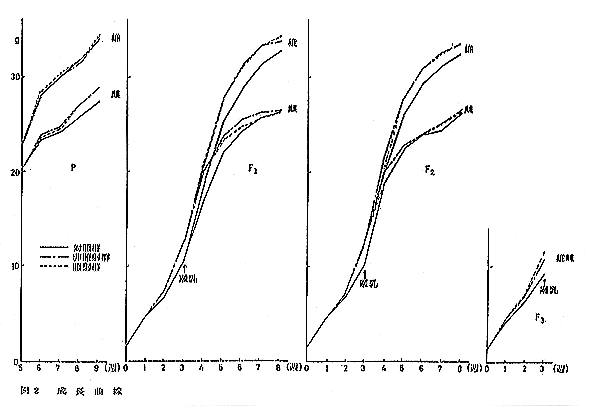
各世代とも、非照射および照射群では動物が大きく、対照群に比べ肥満傾向が観察される。
P世代:雄では群間に差は認めない。雄は6週令以後に非照射および照射群で対照群を上回る増加傾向を示す。
F1世代:0〜3週令(同腹単位で測定)では、非照射および照射群で対照群に比べ2週より増加傾向を示し、3週では有意差を認める。非照射群と照射群の間には差は認めない。
4〜8週令では、雄は対照群に比べ非照射および照射群で増加傾向を示し、非照射群では4〜7週令で、照射群では4〜8週令で有意差を認める。また、雌でも同様の傾向を認める。しかし、雄雌とも非照射群と照射群の間には明らかな差は認めない。
F2世代:F1世代と同様の成長曲線を示す。0〜3週令では、2週令より対照群に比べ非対照および照射群で増加傾向を示し、3週では有意差を認める。4〜8週令では、雄の非照射群で4〜7週、照射群の6週で有意に高値を示す。雌は群間に有意差を認めない。非照射群と照射群の間には全期間を通し、雄雌とも殆んど差を認めない。
F3世代:F1およびF2世代と同様、対照群に比べ非照射および照射群では増加傾向を示す。有意差は3週令の対照群と照射群の間に認められる。非照射群と照射群の間には殆んど差を認めない。
 |
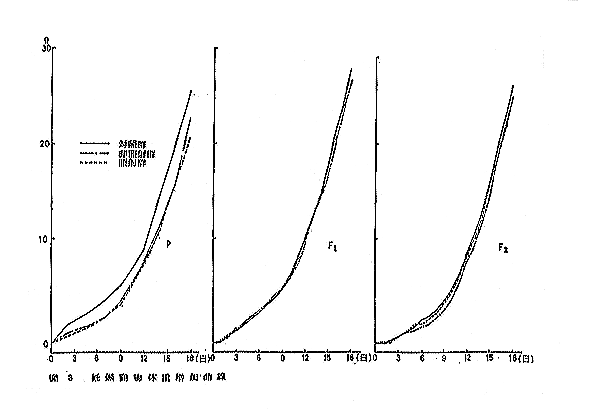
P世代:対照群に比べ非照射および照射群とも2日目より明らかに低値を示す。非照射群と照射群の間には殆んど差を認めない。
F1およびF2世代:3群間に殆んど差を認めない。
 |
PおよびF1世代:検査項目により群間に多少の差は認めるが、いずれの検査項目でも有意差は認められない。
F2世代:哺育率および離乳率は対照群に比べ非照射および照射群で高値を示す傾向を認め、特に哺育率では有意差を認める。
P世代:いずれの検査項目でも群間に明らかな差は認められない。しかし、死亡胎仔数は対照群に比べ非照射群で低値を示す傾向を認める。なお、照射群で1例認められる外形異常胎仔は脳ヘルニアである。
F1世代:平均着床数は対照群に比べ非照射および照射群で高値を示し、非照射群は有意差を認める。この他、外形異常胎仔数が対照群に比べ非照射群で高値を、総死亡胎仔数が対照および非照射群に比べ照射群でやや低値を示す。しかし、いずれも有意差は認めない。外形異常胎仔は非照射群の皮下出血1例を除いて全例内反足である。
F2世代:いずれの項目でも、群間に殆んど差を認めない。なお、外形異常胎仔は対照群で皮下出血および内反足を各1例、非照射群で内反足1例を認める。
イ)肉眼的変化:F1世代では、照射群の1例に精巣の左右不対称を認める。F2世代では、非照射群の雄の2例に腎臓欠損(片側性)を認める。F3世代では、対照群の雄の2例に腎臓の水泡形成を認める。
ロ)臓器重量(表3):各世代の雄雌とも、対照群に比べ非照射および照射群で肝臓重量の有意の増加あるいはその傾向を認める。また、F3世代では精巣重量に同様の傾向が認められる。
F1世代:化骨進行度(踵骨・距骨の骨化および趾骨中節の骨化)が対照群に比べ非照射および照射群で稍々低値を示す。
F2世代:頚肋が対照および非照射群に比べ照射群で低値を示す傾向を認める。また、化骨進行度では踵骨、距骨の骨化が対照群に比べ非照射および照射群で僅かに低値を、距骨中節の骨化が対照および非照射群に比べ照射群で僅かに高値を示す。しかし、いずれの項目でも群間に有意差を認めない。
F3世代:頚肋が対照群に比べ非照射群で、腰椎の仙椎化が対照および非照射群に比べ照射群で、踵骨・距骨および趾骨中節の骨化が対照群に比べ非照射および照射群で、いずれも高値を示す傾向を認める。しかし、いずれの項目でも群間に有意差は認めない。
F1世代:いずれの項目でも群間に殆んど差を認めない。
F2世代:仙椎+尾椎数が対照群に比べ非照射および照射群で有意に低値を示す。腰椎の仙椎化は対照群に比べ照射群で高値を示す傾向を認める。しかし、いずれの項目も非照射群と照射群の間には殆んど差を認めない。
F3世代:腰椎の仙椎化が対照および非照射群に比べ照射群で高値を示す傾向を認め、非照射群との間に有意差が認められる。この他の項目では群間に明らかな差は認めない。
P世代動物のうち、F1世代の親動物に使用した仔(交配に用いた動物)を分娩した動物について、腰椎の仙椎化を検査した結果、対照および非照射群に比べ照射群では交配した雄雌のうち一方あるいは両者に腰椎の仙椎化を認める組合せ数が多く観察される(表6)。また、F3世代動物のうち新生仔の骨格検査を行なった動物を分娩したF2世代動物を遡り、P世代動物について腰椎の仙椎化を検査した。照射群では対照および非照射群に比べ腰椎の仙椎化を認める交配組数が高頻度で認められる(表7)。一方、P世代で仙椎化が認められない動物だけの組合せによって得られたF3世代(新生仔)では仙椎化は1例も認められない。
照射ウインナーソーセージの繁殖生理におよぼす影響ならびに催奇形性の有無を調べる目的でマウスによる連続3代の世代試験を行なった。
各世代とも、成長曲線、妊娠母獣体重増加曲線、繁殖生理値、妊娠末期胎仔への影響および新生仔の臓器重量の検査では非照射群と照射群との間に差は認められず、照射ウインナーソーセージ摂取による影響は認められなかった。妊娠末期胎仔および新生仔の骨格検査では、腰椎の仙椎化がF3世代(末期胎仔および新生仔)で対照および非照射群に比べ照射群で高値を示す傾向を認めた。これは、照射群ではP世代に仙椎化を認めた動物の交配が他の群に比べ高率に行なわれていること、一方、P世代で仙椎化を認めない動物の交配の組合せを持つF3の新生仔では、仙椎化を1例も認めないことより、F3世代の照射群で仙椎化が高率に認められるのはP世代に仙椎化を認めた動物の交配が他の群に比べたまたま高率であったことに起因すると考えられる。
以上のことより、本実験条件下で照射ウインナーソーセージ摂取による影響は認められなかった。
なお、F1世代動物を用いた慢性毒性試験では、動物飼育室の環境因子が原因と考えられる途中死亡動物が各群とも高率に発生したため(24ヶ月目の累積死亡率:雄の対照80.0%、非照射68.3%、照射82%、雌の対照86.0%、非照射89.7%、照射88.8%)慢性毒性試験の目的を達することができなかったので、新たに動物を購入して実施した。
照射食品について遺伝学的安全性を評価するためには試験法の選択がきわめて重要である。数多くの遺伝毒性試験のうちどれを取り上げるべきかについては、試験対象の重要度に応じて配慮されるべきであろうが、ウインナーソーセージはその消費量もかなり大きいことを考慮して、厚生省が公にした「食品添加物などの遺伝的安全性評価の基準」に示された各種の試験法をほぼカバーするに足りる項目の試験法を選択した。なお哺乳動物を用いる特定座位試験は現時点において、最も信頼するに足る試験法とされているが、その実施には莫大な費用を要し、しかも試験法自体検討の余地が大きいとされている点を考慮して今回は実施を見送った。照射食品について哺乳動物による特定座位試験が実施されたという報告は諸外国においても皆無であり、哺乳動物による優性致死試験の結果が最も重視されているのが現状である。
実施した試験項目は次の通りである。
1.細菌を用いた突然変異誘発試験
1)細菌に対する突然変異誘発試験
2)マウスによる宿主経由試験
2.哺乳動物培養細胞を用いた突然変異誘発試験
1)染色体異常試験(試験管内)
3.哺乳動物の生体を用いた突然変異誘発試験
1)染色体異常試験(マウス生体による小核試験)
2)マウスによる優性致死試験
検体の製造は高崎ハム株に依頼し、照射は日本原子力研究所高崎研究所で実施した。照射線量は0.6Mrad(0.3Mrad/時)。検体は照射・非照射とも直ちに凍結乾燥し−20℃で保存した。
(イ)検定菌:Salmonella typhimurium TA100,TA98,TA1535,TA1537,TA1538,およびE.coli WP2 uvrAを使用した。
(ロ)試験検体:照射および非照射ウインナーソーセージの凍結乾燥物を水または酢酸エチルで抽出したものを試験試料とした。
(ハ)試験操作法:プレート法(Plate incorporatio
method)によった。
試験結果は表A−1に示すごとくで、6菌株のすべてについて照射・非照射を問わず、陰性対照にくらべて変異集落の増加は認められなかった。
以上の結果から、照射食品は使用した試験系について突然変異性を有しないものと結論される。
検定菌としてSalmonella typhimurium G46を用い、BDF1雄マウス(24〜26g)に照射および非照射ウインナーソーセージの抽出物(水およびクロロホルム・メタノール抽出物を混合)0.3gを1回腹腔内投与した。
表A−2に示すごとく1平板あたりの変異コロニー数に関して、対照、照射および非照射群の間に有意の差は認められなかった。
チャイニーズ・ハムスターの胎仔細胞(初代細胞)とヒトのリンパ球に、ウインナーソーセージの水抽出物を最終濃度1mg/ml,2mg/mlになるように培地に加え、24時間後に染色体標本を作製した。観察はハムスター細胞では100個、ヒトリンパ球では50個の分裂中期像について行なった。
照射、非照射のいずれにおいても、有意な染色体異常の増加は認められなかった。
照射および非照射ウインナーソーセージのクロロホルム:メタノール(2:1)抽出物と水抽出物の混合物をBDF1(9週令)雄マウスに経口的に1回投与した。投与24時間後に屠殺し、骨髄細胞の塗抹標本を作製した。観察はマウス1匹あたり1500個の多染性赤血球をカウントし、その中の小核を有した多染性赤血球の出現頻度を求めた。
表A−4に示すごとく照射および非照射群のいずれにおいても小核の有意な増加を認められなかった。
BDF1雄マウス(静動協)に対しても6週令から14週令までの8週間にわたり照射および非照射、ウインナーソーセージ飼料を与えた。陰性対照には固型OMF飼料を与え、陽性対照群はmethyl methanesulfonate(MMS)を同期間4日毎に1回(計14回)、1回につき12.5mg/kgを腹腔内投与した。実験に用いた雄マウスは各群30頭とし、陽性対照群の20頭とした。投与後1頭の雄マウスに対し1頭の雌を4日間にわたり交配し、この交配を2回くり返した。交配後妊娠中期に雌マウスを屠殺、開腹し、黄体数、生存および死亡胎仔数を調べ、優性致死誘発率を求めた。優性致死誘発率は下記の2通り(A,B)の式により算出した。
A=[1−(妊娠雌あたりの生存胎仔数:処理群/妊娠雌あたりの生存胎仔数:対照群)]×100
B=[1−(妊娠雌あたりの生存胎仔数/着床数:処理群) ÷ (妊娠雌あたりの生存胎仔数/着床数:対照群)]×100
また陽性対照群以外の群において処理期間中、週に1度体重および摂餌量を測定した。
体重および摂餌量は投与期間を通じて、多くの場合、陰性対照群をうわまわっていた。
表A−5にそれぞれの群の平均黄体数、着床数、生存胎仔数、ならびに誘発優性致死率を示す。非照射および照射のウインナーソーセージ群のすべてにおいて、誘発優性致死率は負の値を示した。このことは陰性対照群の着床数の少なかったことと、上にのべた様に実験群での体重および摂餌量が陰性対照群よりほとんどの場合統計的に有意に高いことを起因するものと思われた。またウインナーの非照射、照射群間において有意な差は認められず、これらの結果からウインナーのCo−60による照射によって優性致死誘発作用を有する物質の生成などは起こさないものと結論された。