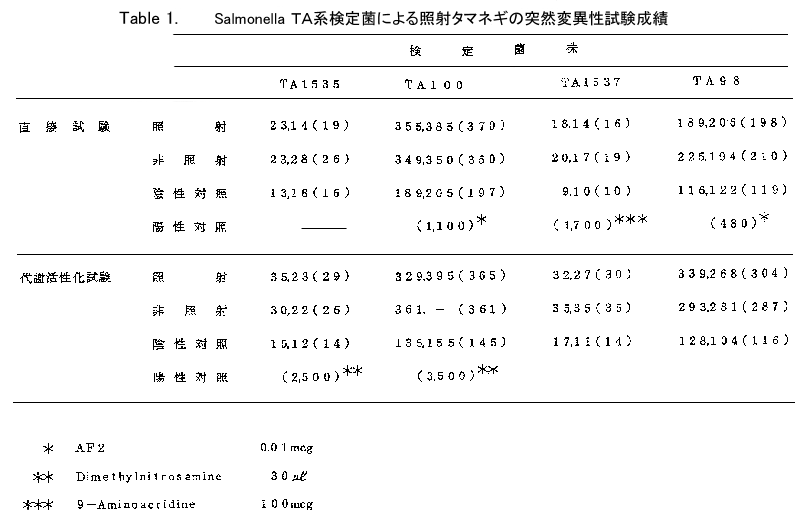
Table 1. Salmonella TA系検定菌による照射タマネギの突然変異性試験成績
 |
照射食品について遺伝学的安全性を評価するためには試験法の選択がきわめて重要である。数多 くの遺伝毒性試験のうちどれを取り上げるべきかについては、試験対象の重要度に応じて配慮され るべきであろうが、今回のタマネギは基本的な食品でその消費量もきわめて大きいことを考慮して、 厚生省が公にした「食品添加物などの遺伝的安全性評価の基準」に示された各種の試験法をほぼカ バーするに足りる5項目の試験法を選択した。なお、哺乳動物を用いる特定座位試験は現時点におい て、最も信頼するに足る試験法とされているが、その実施には莫大な費用を要し、しかも試験法自 体検討の余地が大きいとされている点を考慮して今回は実施を見送った。照射食品について哺乳動 物による特定座位試験が実施されたという報告は諸外国においても皆無であり、哺乳動物による優 性致死試験の結果が最も重視されているのが現状である。
今回実施した試験項目は次の5つであるが、実験条件の細部にわたってとくに優性致死試験につい ては、一群の雄の頭数、交配期間など従来とかく議論の的となりやすかった点について充分の配慮 の下に試験を行った。
細菌に対する突然変異性試験
細菌を用いる宿主経由試験
染色体異常試験(試験管内)
染色体異常試験(生体内)
マウスを用いる優性致死試験
また、試験に用いた検体は淡路島において収穫(昭和52年6月)されたタマネギ(淡路中高)を約 1ヶ月後日本原子力研究所高崎研究所において15Kradのガンマ線照射を行い、非照射検体とともに 試料調製まで2~3℃の暗所に保管した。
試料の調整は試験項目に応じて異なった方法で行ったため、それぞれの項目で述べることとした。
タマネギは各種の揮発成分を含有することが知られており、毒性試験にさいしてはこれらの成分 を含めて実施することが望ましいと考えられる。しかし実験に用いる試料を調整するためには、 in vitro試験については無菌ジュースの作製、in vivo試験ではジュースをとった残渣をホモジナイ ズする操作がさらに必要となる。ところがこの種の操作は、予備実験の結果から揮発成分の大部分 を失わせるものであることが明らかにされた。さらに、mildな操作によっても揮発成分の喪失を防 ぐことが不可能であることが分かり、通常の調理法によってタマネギを摂食するかぎりでは摘発成 分はそれほど考慮しなくてもよいであろうという結論に達した。したがって今回実施した試験のう ち一部のものについては、安全係数を見込むため、凍結乾燥法の併用によって濃縮した試料を使用 し、可及的大量を投与することを試みた。
タマネギは変化し易く複雑な食品であるので安全性試験の飼料調製に際しその特性を考慮して種 々検討する必要がある。即ち水分が90%近く品質が変化し易いので、試料としては乾燥又は濃縮に より水分を少なくする必要がある。又成分的には著量の含硫アミノ酸誘導体を含み組織を壊すとこ れが速やかに酵素的化学的反応により変化するし、糖分も多く加熱乾燥などにより変化しやすい。 その他成分は部位によっても幾分含量が違い、栽培・収穫・貯蔵等の条件によっても差異がある。 試験はタマネギ全体を供与することが望ましいが均一にする必要がある。また食用に供する場合の 形態即ち煮食、スライスで生食などの条件も考慮する必要があろう。そこで、試料の調製方法とし て、
1)生タマネギをスライスしたもの
2)同上を凍結乾燥したもの
3)同上を温風乾燥したもの(40℃)
4)同上を熱風乾燥したもの(80℃~100℃)
5)生タマネギをジューサーで処理し更にホモジネートにしたもの
6)生タマネギをミキサーでホモジネートとしたもの
7)生タマネギを低温でメタノールを加えてミキサーでホモジネートしたもの
8)生タマネギを電子レンジで加熱したのちホモジネートとしたもの
9)生タマネギを煮沸したのちホモジネートしたもの
これらのものについてヘッドスペースガス、エーテル抽出物のガスクロマトグラム(GLC)を比 較し、又、80%エタノール抽出物中の糖(グルコース、フルクトース、シュクロース)をGLCで定 量比較検討した。結果として、含硫化合物を主体とするGLCにおいてヘッドスペースガスではスラ イスしたものは催涙性物質、特徴的刺激臭物質などがみられるが、ホモジネートにしたものは殆ん ど出ない。又エーテル抽出物のパターンもかなり差異があった。電子レンジ処理、直接凍乾したも のは組織をこわしても特徴的香気を生成しない
糖類は、ミキサーとスライス、生鮮物を凍結乾燥、とでは殆んど差異はないが、熱風乾燥では明 らかに低下する。又電子レンジと水煮は幾分低下する。γ線照射は5Kradでは変わらないが、 50Kradでは幾分低下した。5℃で保存中4~5ヶ月では低下する。タマネギ鱗葉の外側と内側では含 量が幾分差がみられた。
ウィルス、細菌、かびなどの微生物は変異原性試験における検定生物として有用であるが、なか でも細菌による試験は手間と経費をあまり必要とせず、しかも短時間で結果が得られるという利点 をもっているため広く利用されている。
しかし細菌類はきわめて下等な生物であって哺乳動物の細胞とは構造的にいちぢるしい差がみら れ、しかも生殖の様式については根本的に異なっている。したがって細菌による突然変異誘発試験 は単に細胞内の遺伝物質に対する傷害作用の有無を知ることを主な目的とするものであって、狭義 の遺伝毒性を明らかにするためには哺乳動物を用いる試験を省略することはできない。ただし今日 一般に行われている哺乳動物による遺伝毒性試験は未だ改良の余地が多いとされており、したがっ て細菌による突然変異性試験は補助的手段として有用な役割を持つものと考えられる。
細菌による突然変異誘発試験に用いられる菌株は数多いが、Amesらによって開発され、今日広く 用いられているネズミチフス菌(TA1535、TA100、TA1537、TA98)を使用することとした。ただし、 これらの菌株による試験はヒスチジン要求性から非要求性への復帰変異を目標として行われるもの であるため、タマネギエキスのようにヒスチジンを含有するような試料についての試験に用いるこ とには問題があるかもしれない。しかし今回の試験は、タマネギのもつ突然変異性についてガンマ 線照射前後の比較を行なうことを主目的とするものであるから、上記TA系菌株を検定菌として使用 することに大きな矛盾はないと考えてよかろう。
【試験方法】
検定菌
Salmonella typhimurium TA1535、TA100、TA1537、およびTA98
試験にさいしては0.4% NaCl 加 nutrient froth(Difco)(TA100およびTA98についてはアンピ シリンを100mg/ml添加した)を入れたL字型試験管に種菌を接種し、37℃で4~5時間振とう培養し て所定の濃度に達した時点で試験に用いた。
試験検体
宿主経由試験の場合と同様な方法でタマネギエキスを作製した。ただし濃縮は行わず、メンブラ ンフィルターを用いて無菌濾過した。
試験操作法
いわゆる平板混入法(plate incorporation method)によった。
検定菌液0.1ml、タマネギエキス0.5ml、S-9混液1)またはリン酸緩衝液0.5mlを内 径13mmの試験管中に入れ、融解したtop agar2)2mlと混合しbase agar3) 平板上に流して固める。培養は37℃で48時間行い、発生した変異集落を算定した。
1)S-9混液(1ml中下記の成分を含む)
S-9※※ 0.3ml G-6-PDH 0.32U
MgCl2 8μmole NADPH 4.6μmole
KCl 33μmole 0.2Mリン酸緩衝液(PH7.4)
C-6-P 5.8μmole 100μmole
2)Top agar
Bact agar 0.6% L-Histidine・HCl 0.05mM
NaCl 0.6% Biotin 0.05mM
3)Base agar(培地1Lあたり)
MgSO4・7H2O 0.2g Glucose 20g
Citric acid・H2O 2g NaCl 5g
K2HPO4 10g Bacto agar 15g
NaNH4HPO4 3.5g
径90mmシャーレ1枚あたり30mlを流して固める。
※※ PCB500mg/kgをラットの腹腔内に投与5日後、肝臓をとり出し3容量の0.15MkCl水 溶液とともに磨砕したのち9000g、10分遠心沈殿を行い、その上清をS-9とした。
【試験結果】
試験結果は表に示すごとくで、直接試験において、試験に使用した4菌株のすべてにタマネギエ キス添加の場合には照射、非照射を問わず、陰性対照にくらべ変菌集落の増加がみられた。しかし 照射、非照射両群間に著しい差は認められなかった。
代謝活性化試験(S-9添加)においても直接試験の場合と同様の結果がえられた。
タマネギエキスの添加による変異菌の増加が、試料中のアミノ酸などの影響による検定菌の増殖 促進に起因するものかあるいは真の突然変異によるものか明らかでないが、照射群と非照射群とに ついて変異集落数の点で差が認められなったことから、少なくとも照射によって突然変異性が増殖 されることはないと結論される。
 |
実験方法:タマネギ濃縮エキス作製:照射および非照射タマネギについてそれぞれ生および20分 間蒸したタマネギの濃縮エキスを以下の方法で作製した。皮をむき頭部と根を切り落としたタマネ ギを8等分に縦割りにし、室温でジューサーミキサー(富士電機製JC400)を用いてジュースを作り、 桐山ロートを用いて吸引濾過を行った。このろ液をロータリーエバポレーターで酸化防止のため装 置内の空気をN2に置換した後に35~40℃で濃縮操作を行った。濃縮エキスは保存ビン 内の空気をN2で置換したのち、-20℃のフリーザーで凍結保存した。
急性毒性試験:9週令のBDFⅠ雄マウスを用いて非照射タマネギの生および蒸したも のについてそれぞれ10倍および5倍濃縮エキスの急性毒性試験を行った。各々のエキスについて1日 1回0.5mlまたは1mlを3日間連続経口投与し、投与後1週間経過を観察した。投与期間中に死亡した ものについては剖検を行った。
検定菌:Sal typhimurium G46株を用いた。0.4%NaCl 加 nutrient broth(Difco)を用いて、 37℃で一晩往復振とう培養し、これをさらに新しい上記培地で10倍に希釈して37℃で1時間往復振 とう培養を行い、本試験用菌液とした。
宿主経由試験:9週令のBDFⅠ雄マウス(23~27g)を用いて照射および非照射タマネ ギについてそれぞれ生タマネギは2.5倍、5倍濃縮エキス、蒸しタマネギは5倍、10倍濃縮エキスに ついて試験した。マウスは1群5匹とし、タマネギエキスを1日1回0.5mlずつ対照群には同一条件で 蒸留水を3日間連続経口投与した。3回目の投与と同時に検定菌液1mlを腹腔内に投与し、3時間後に 頚椎脱臼によってと殺を行い、生理食塩水1mlを腹腔内に注入して腹部を軽くもんでから注射器を 用いて腹腔内を回収した。
Mutant数の測定:回収した腹腔液0.1mlを2mlの軟寒天にまぜ、2%ぶどう糖加Vogel-Bonner培地 30mlを流し固めた平板培地上に流し、37℃で48時間培養後発生した集落数を算定し、mutant数とし た。
生菌数の測定:回収した腹腔液をNa・Kbufferを用いて10倍希釈を行い、104~ 107倍希釈液をつくる。それぞれの希釈段階の0.1mlを2mlの軟寒天にまぜ、0.5%NaCl 加 nutrient agar(Difco)20mlを流し固めた平板培地上に流した。これを37℃で24時間培養した のち発生した集落数を算定し、腹腔内1mlあたりの生菌数に換算した。
変異頻度を次式から求めた。
変異頻度 = 腹腔液1mlあたりのMutant数 / 腹腔液1mlあたりの生菌数
結果および考察:急性毒性試験:生タマネギにおいて10倍濃縮エキス1ml投与群は1回目投 与後1時間以内にすべて死亡、10倍濃縮エキス0.5ml投与群は2回目投与後に死亡した。生タマネギ 5倍濃縮エキス1ml投与群は1回目投与後24時間以内に25%が死亡したが、同0.5ml投与群は一週間目 まで生存を確認した。蒸しタマネギにおいては10倍濃縮エキス0.5mlを3回投与後1週間目まで、投与 群マウスすべての生存を確認した。この結果から宿主経由試験に用いるタマネギエキスの濃度を、 生タマネギにおいては5倍濃縮、2.5倍濃縮、蒸しタマネギにおいては10倍濃縮、5倍濃縮とし、1回 の投与量は1匹あたり0.5mlと定めた。
宿主経由試験:照射、非照射は問わず、生および蒸しタマネギ濃縮エキスの全ての用量にお いて対照群との有意差はみられなかった。したがって今回の実験条件下では照射タマネギの変異原 性は認められなかった。
 |
 |
 |
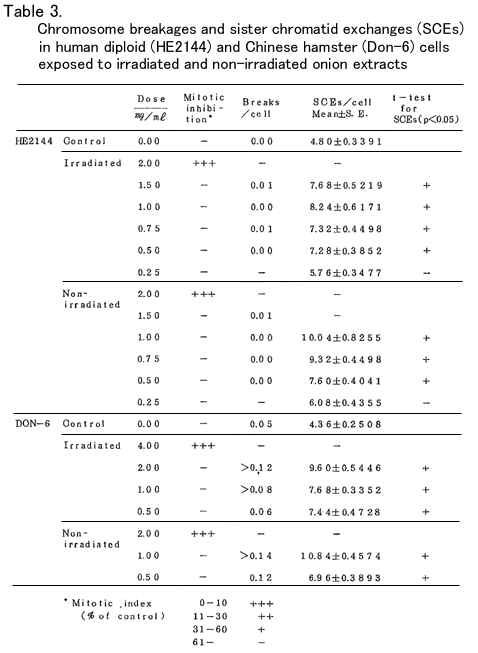
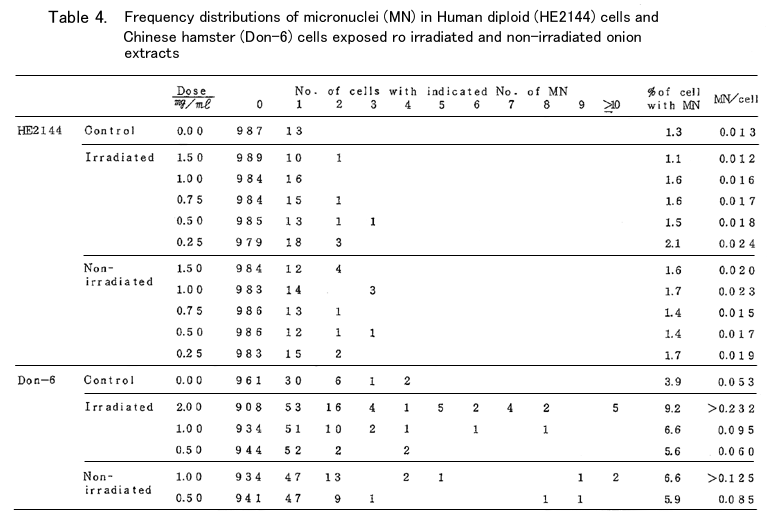
研究方法:ヒト胎児由来の二倍性細胞株(HE2144)およびチャイニーズハムスター細胞株 (Don-6)に生理食塩水に溶解したタマネギ抽出物(秦野研究所において調製した照射および非 照射タマネギエキスの無菌化凍結乾燥粉末)を種々の濃度で加え、その細胞遺伝学的影響を染色 体切断(CB)、姉妹染色分体交換(SCE)、小核形成の3点に関して調査した。
培養液には10~15%牛胎児血清と1μg/mlのBrd Uを含むイーグル培地を用いた。処理時間はヒト では48時間、ハムスターでは36時間(いずれも2細胞周期に相当する時間)とし、37℃の暗黒中で 培養を行い、固定前2~3時間に0.25μg/mlのコルヒチンを添加して中期分裂傷を蓄積させた後、染 色体標本を作成した。ギムザ染色体により、CBは100個の中期分裂像、小核は1000個の分裂間期細 胞について、SCEはアクリジンオレンジ蛍光法により25個の投与後第2回目の分裂細胞について、そ れぞれの頻度をしらべた。又、各実験群毎に無処理の対照を作り、1000細胞に対する分裂頻度と 200個の分裂細胞中の高倍数性細胞(主として4倍性)の出現率を処理群のそれらと比較した。
結果:ヒトの細胞(以下HEと略す)では照射検体(Ir)、非照射検体(Non-Ir)共に2.0mg/ml でいちじるしい分裂抑制がみられ、分裂頻度は無処理対照に比べ10%以下に低下し、CBもSCEも観 察することができなかった。ハムスター(D-6)ではIrは4.0mg/ml、Non-Irは2.0mg/mlで同様の 分裂抑制が見られたが、Irの2.0mg/mlでは抑制されず、HEよりも高い抵抗性を示した。
1細胞当りのCBは検体を加えない場合には、HEでは0.00、D-6では0.05であったが、検体を加えた 場合には、D-6ではIr2.0mg/mlで0.12、Non-Ir 1.0mg/mlで0.14以上に増大し、それ以下の投与量 おいても濃度依存的にCBの増加がみられたが、HEにおいてはIr、Non-Ir共に1.5mg/mlまでの投与 に対し0.01以上に増加することはなく、濃度依存性も認められなかった。この結果からD-6にはCB を誘発するが、HEにはほとんど影響がないと考えられた。また、D-6においてはIrよりもNon-Irの 方が多少強い作用を示した。
同様のことはCBの結果生じたと考えられる小核を有する細胞の出現率の変化によっても推察され た。すなわち、1細胞当りの小核数は、無処理対照ではHEで0.013、D-6では0.053であり、HEでは 2個以上、D-6では5個以上の小核を有する細胞は認められなかったが、D-6の処理群では、Ir2.0 mg/mlで0.232、Non-Ir 1.0mg/mlでは0.125以上に増加し、6~10以上の小核を有する細胞が可なり の頻度で出現し、濃度依存性も認められた。一方、HEの処理群においては、2個以上の小核を有する 細胞が多少増加することもあったが、濃度依存性が認められず、1細胞当たりの小核数も高濃度処理 において有意に高くなることはなかった。
SCEに対する影響はHE、D-6共に認められ、無処理対照におけるI細胞当りのSCEはHEでは4.80± 0.039、D-6では4.36±0.250であったが、処理群では濃度依存的に2倍前後までの増加が認められた。 たとえば1.0mg/mlにおける数値を比較すると次の通りである。HEではIr 8.24、Non-Ir 10.04。D6で
いずれの実験群においても高倍数性細胞の出現率が増大するという傾向は認められなかった。
考察と結論:以上の実験結果からタマネギの成分中には細胞分裂の抑制、染色体切断、姉妹染色 分体交換を誘発する物質が含まれていると考えられるが、照射によってこれらの作用が増大すると は考えにくい。今回の実験において照射群の方が非照射群よりも弱い影響を示したことは、検体の 調製過程、サンプルの偏りなどを考慮して追試した上で結論する必要がありそうである。ヒトの細 胞で染色体異常が誘発されなかったことはタマネギに限った問題ではなく、今後の研究によりこの ような感受性の違いの原因と機構を追究する必要がある。SCEの増加はヒトとハムスターに共通の現 象であり、染色体切断とは異なった機構によるものと考えられるが、その増加率は対照の2倍程度で あり、それほど大きいものとは考えられない。今後はタマネギの成分を分画し、その中の何が染色 体異常を誘起するかを明らかにし、そのような物質の少ない品種を育成する必要があるかも知れな い。
 |
 |
試験方法:
照射タマネギ試料の調製:収穫タマネギは、15Kradのγ線照射後5ヶ月間2~3℃の冷暗所で貯蔵 した。試料は均一になるように1個のタマネギの1/4をとり、それを5個以上あわせて、それぞれ1cm 幅に切り市販のジューサー・ホモジナイザーにて粉砕しタマネギホモジネートを得た。このホモジ ートを凍結乾燥し、得られた凍結乾燥粉末に適宜水を加え、それぞれの濃度段階の試料とした。 なお、凍結乾燥粉末の収率は約10%であった。
実験動物と投与方法:BDFⅠ(C57 BL×DBA)雄マウス、9週令、20~25g、30頭を用 いた。次の様に、それぞれ5頭づつ、6群に分けた。
①陰性対照群(蒸留水)、②照射群(2000mg/kg)、
③照射群(4000mg/kg)、④照射群(8000mg/kg)、
⑤非対照群(8000mg/kg)、⑥陽性対照群(methyl methanesulfonote:100mg/kg)
①-⑤については経口的に5日間連続投与し、⑥については5日目に1回腹腔投与した。
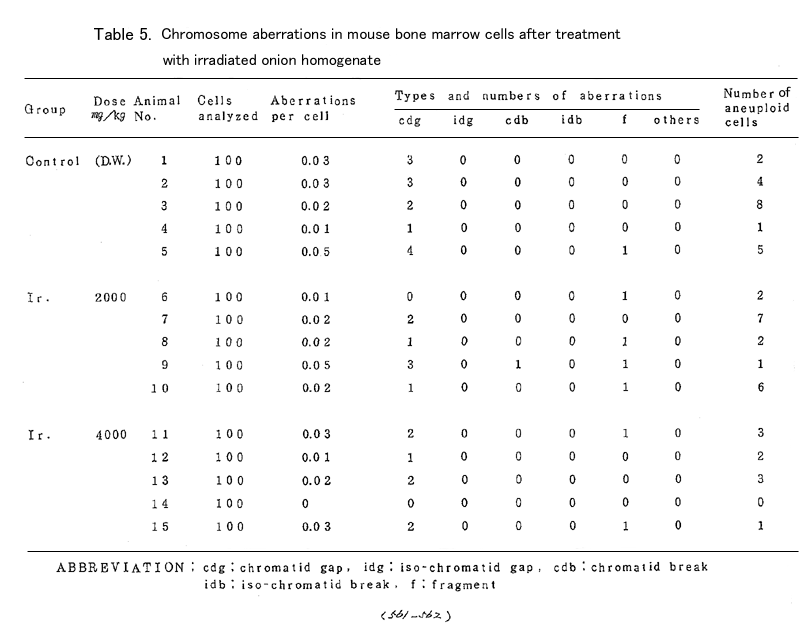
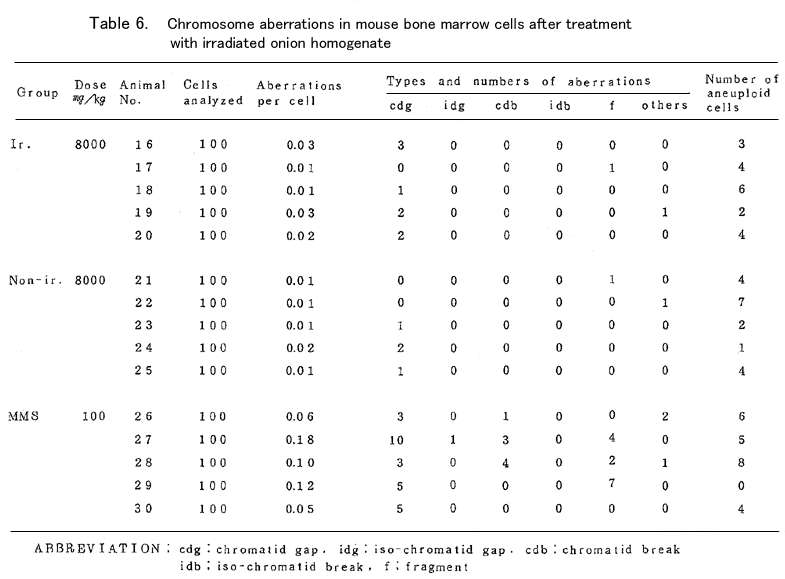
染色体標本の作製と観察:最終投与の20時間後、殺す1.5-2.0時間前に4mg/kgのコルヒチンを腹 腔内投与し頚椎脱臼により殺した。後肢より0.015MKCl溶液で骨髄細胞を洗い出し、20分間低張処 理後、常法によりカルノア固定、空気乾燥した。染色体の観察は2名の観察者によりブラインド法 で1個体あたり100個の中期細胞を分析した。観察された染色体異常については、gap、break、 deletion、exchange及び異数性細胞について調べ、それぞれの頻度を細胞あたりの数で算出した。
試験結果:(Table5、6)
照射検体投与群はいずれの濃度においても対照群と比べ染色体異常の有意な増加はみられなかっ た。特に8000mg/kgの5日間連続投与という照射検体の最高投与群においても対照群と比べ有意な増 加はみられなかった。
更に非照射検体投与群においても同様に有意な増加はみられなかった。一方陽性対照として投与 したmethyl methanesulfonote 100mg/kgの投与群では、細胞1個あたりの染色体異常は0.10±0.04と 対照群の約6倍の高い値を示した。照射及び非照射検体投与群において観察された染色体異常の多く は染色分体系のgapがほとんどで、その他少数のfragmentなどがみられた。異数性の細胞については 標本作製の過程で生じたと思われる低倍数性の細胞がかなりみられたが、高倍数性の細胞について は、ほとんど対照群と同じレベルであった。
以上の結果よりマウスを用いた生体内の染色体異常試験は照射、非照射群ともに何ら異常がみら れなかった。
考察:
本試験法は、FDA(米)及びAd Hoc 委員会(米)の推奨する国際的に最も標準的な試験法に準じ て行い、投与量は8000mg/kgという最大投与量を含み、しかも5日間連続投与という通常我々の摂取 している量に比べ大量のタマネギを投与している。従って本試験条件下では、照射及び非照射群と の間に何ら異常の差を見い出す事が出来なかった事より、タマネギの放射線照射による変異原性の 出現(増大)はないと思われる。
試料作製についての予備試験において、①マウスの経口投与が可能な試料検体であること、②成 分の損失を最小限におさえる事の2点に留意して検討した。しかしながら、通常我々の食生活に供し ている条件をそのまま実験動物を用いた試験で再現することは不可能に近い。従って、今後検討す る余地があるとすれば、タマネギ試料の場合特に試料作製過程で起る酵素作用による成分変化や、 摘発成分の損失が生じる事が明らかになっている為、投与試料をできるだけ生の状態で投与すると か、加熱した試料を投与するなど、我々の日常食する条件に近い状態で投与試料を作製することが 望まれる。
放射線照射タマネギエキストラクトの生体内でのラット骨髄細胞に対する染色体切断作用を検討 した。
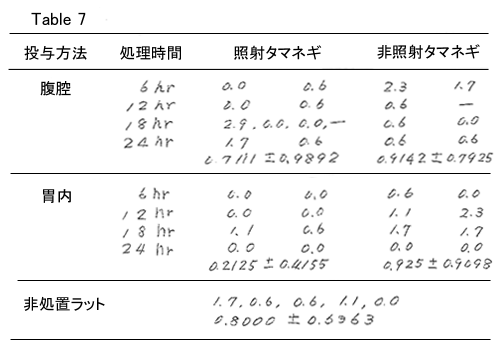
動物はLong-Evans系ラット(生後25-30日、70-100g体重)を用いた。投与の方法は凍結したタ マネギエキスを0、10、20、40、100、400mg/100g体重になるように、経口投与の場合は蒸留水2.0ml に、腹腔内投与の場合には生理食塩水2.0mlにpolytronホモゲナイザーを用いて懸濁して投与した。 投与後6、12、18、24時間の骨髄染色体標本を作製し、染色体切断、ギャップ等の異常を有する中間 細胞の割合(%)を計数した。上記投与量の範囲では400mg/100gの投与量で腹腔内投与をした場合 の2例に死亡がみられ、これらは投与直後の死亡で腹腔内に血性の腹水の貯留をみた。従って400mg/ 100gをほぼ最大耐量に近い量として染色体切断能を非照射タマネギ群、生理食塩水投与群と比較し た。
各動物につきコルヒチン0.1%、0.2ml/100g投与後1時間に大腿骨より染色体標本を作り、1検体に つき175の中期細胞を検索し、染色体切断とgapを有する細胞の%で結果を表現した。これまでの実 験では正常動物では異常細胞の割合は2%未満であり、2%以上3%未満が疑陽性、3%を越える場合 はdoseresponse関係を認める際には陽性と判定した。
結果は腹腔内投与群において18時間後の照射タマネギ群の1例が2.9%と疑陽性であったことから さらに2例追加したが1例は投与直後に死亡し、他の1例は全く陰性であった。6時間群においては照 射群では陰性、非照射群では2.3%の疑陽性を示す例をみ、照射群よりやや高値を呈した。腹腔投与 群では上記2例以外は陰性を呈した。
経口投与(胃内投与)では12時間群において上記と同様な例を非照射群にみ、この時の値は、1.1 %、2.3%であるのに照射群では2例共0%であった。これ以外はすべて陰性であった。
考察:
これらの結果から腹腔内投与、経口投与の何れにおいても照射群、非照射群の何れも3%以上の陽 性域に相当するものはなく、400mg/100gの最大耐量を最大投与量とするdose response関係を見出し えなかった。従って、照射タマネギエキストラクトの細胞遺伝学的作用は、非照射タマネギと共に 変異原性については上記データの示す限りにおいては問題ないと考えられる。
 |
 |
 |
タマネギの投与試料としては凍結乾燥したものを用いた。1回の試料調製には照射、非照射タ マネギとも各々の個体差を考慮して、3ないし4個を用いた。まずタマネギを1/8に縦切りし、家庭 用ジューサーでジュースを作る。次いでこのジュースをジューサー内に残ったかすとともに、ホ モブレンダーで5分間ホモジナイズし、このホモジネイトを凍結乾燥して、これを投与試料とした。 凍結乾燥後の試料の重量はタマネギの重量の約10%であった。
試験にはBDFⅠ(C57BL/6J×DBA/2)-SLCマウスの雌雄とも9週令のものを用いた。 これらのマウスを温度23±0.5℃、湿度55±5%、12時間周期照明の動物室で、固形飼料および水 道水を自由摂取させて飼育した。
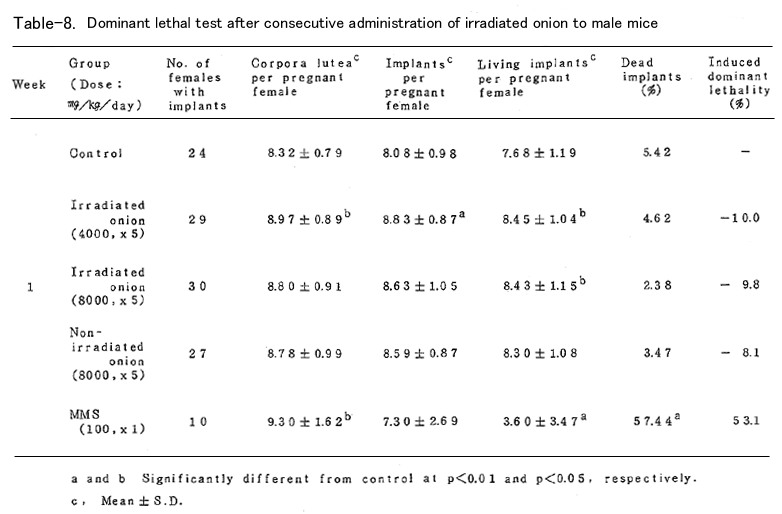
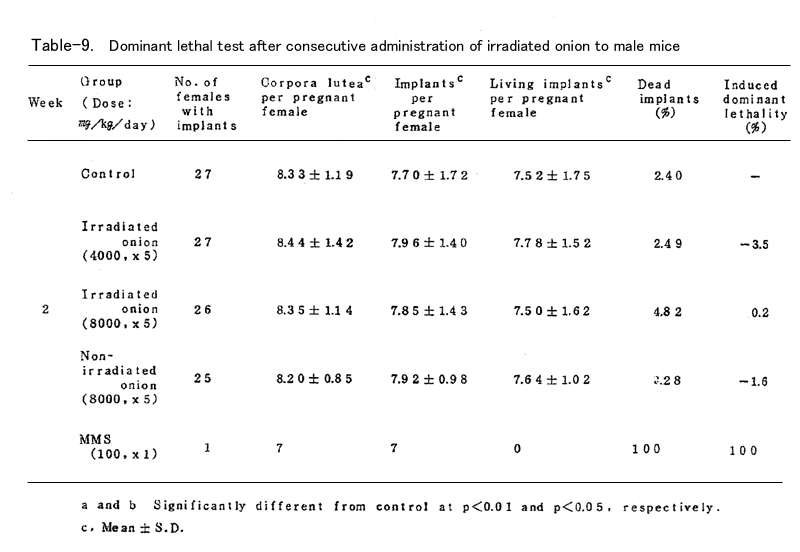
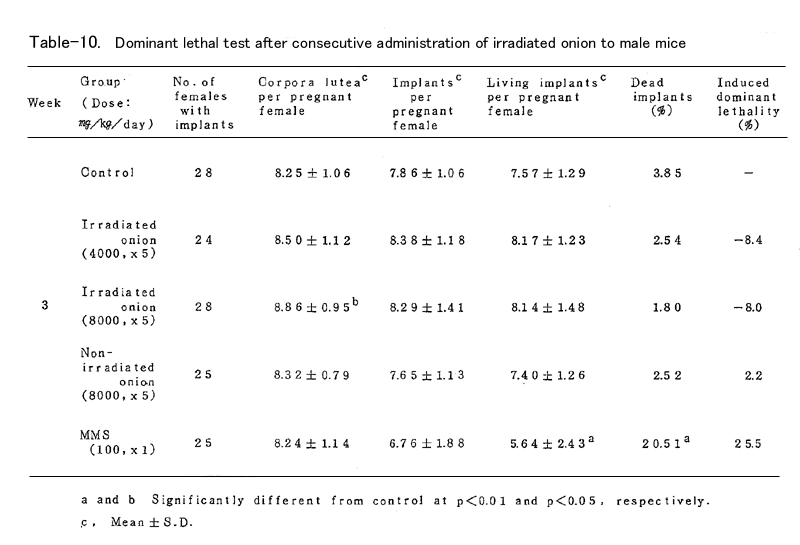
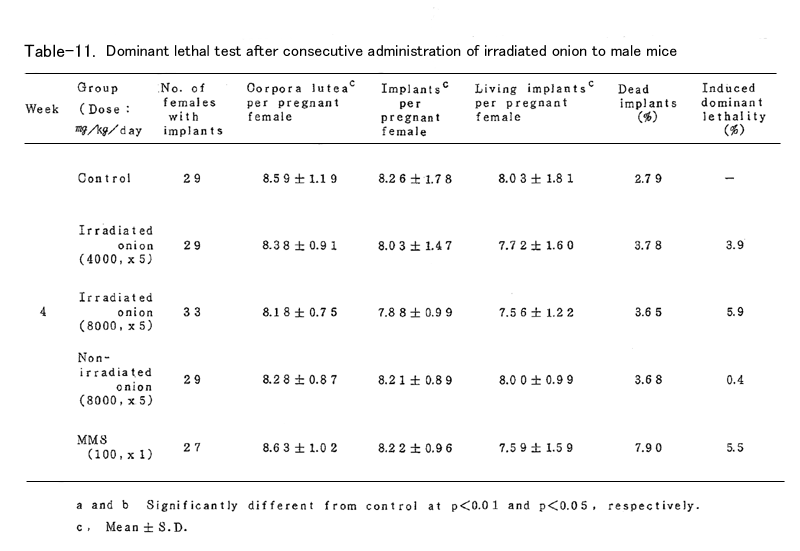
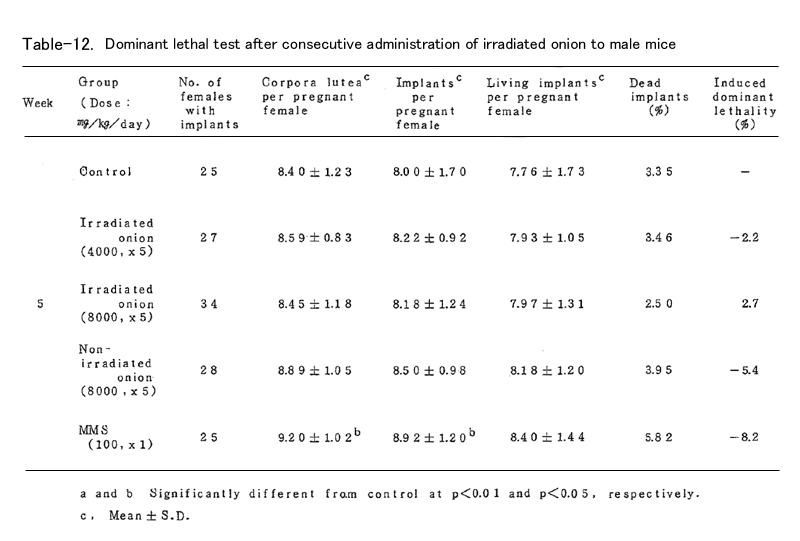
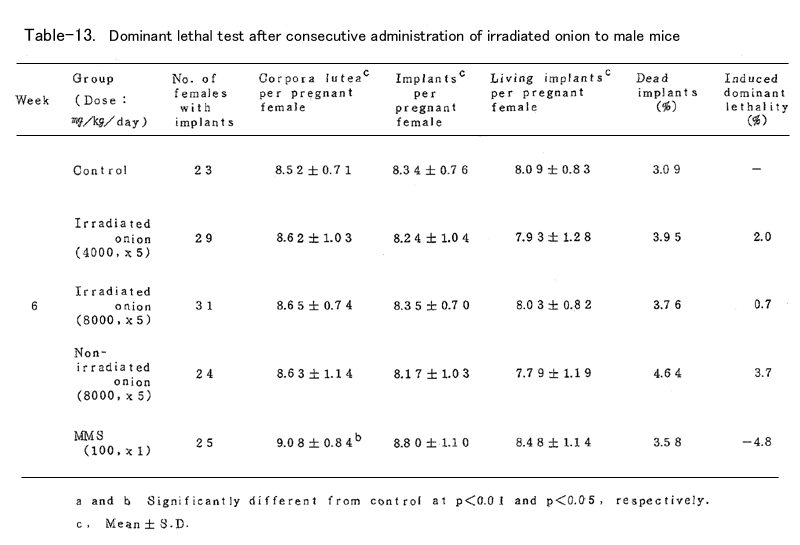
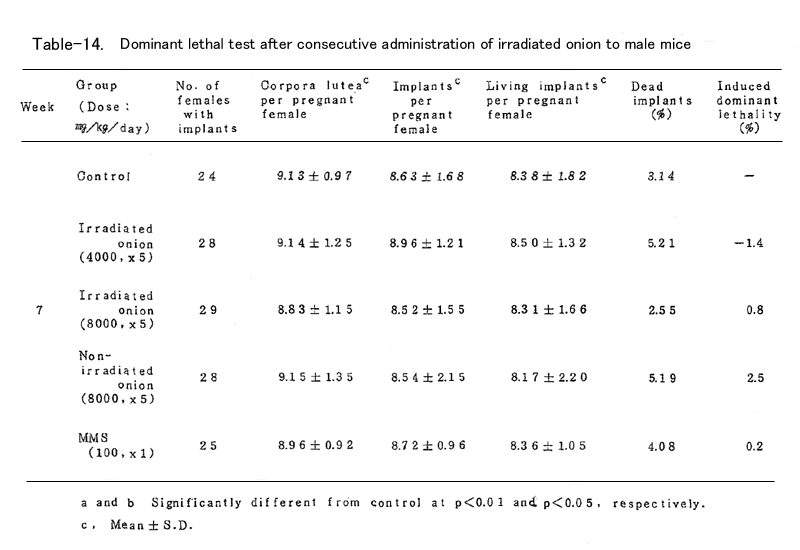
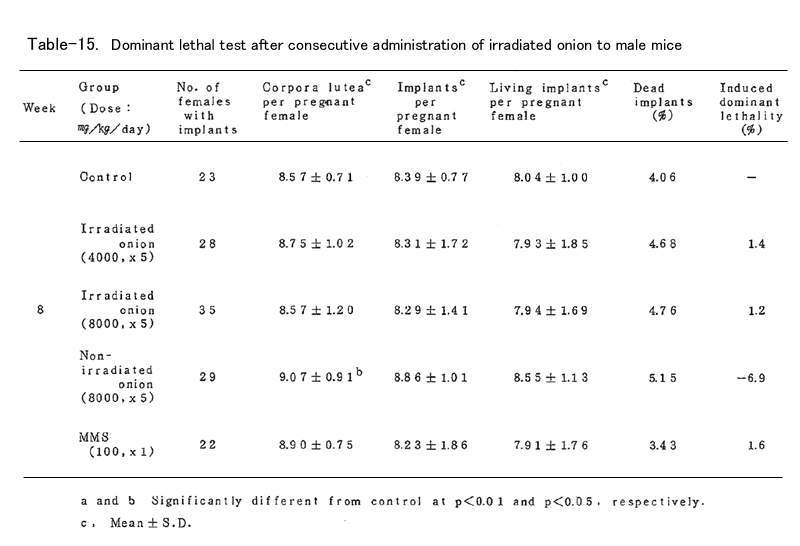
BDFⅠ雄マウスに、上述の凍結乾燥試料を蒸留水中に懸濁し照射群では4000mg/kg (15頭)および8000mg/kg(19頭)、非照射群では8000mg/kg(16頭)を、BDFⅠ雄マウ スに胃ゾンデを用いて連続5日間経口投与した。対照群(15頭)としては蒸留水を連続5日間経口 投与し、陽性対照群(15頭)にはmethyl methanesulfonote(MMS)を腹腔内に1回投与した。いず れの群においても投与液量が40ml/kgとなるように調整した(ただし照射群4000mg/kgでは20ml/ kg)。これらの雄マウスを投与終了後8週間にわたり、無処理の未経産雌マウス各週2頭と交配し、 腟栓の確認された雌は分離飼育し、妊娠の成立の有無を観察した。妊娠した雌は妊娠13日目に解 剖し、黄体数、着床数(生存および死亡着床数)を調べた。これらの数値は週単位に分けて集計 し、対照群と処理群とを各週について比較した。
これらの数値より
1.死亡着床率(postimplantation egg loss)
死亡着床数 / 着床数 ×100
2.優性致死誘発率J(frequency of dominant lethals)
J = 処理群雌あたりの生存着床数 /( 1-対照群雌あたりの生存着床数 )×100
を算出した。
表に結果を示した。各処理群とも妊娠率では対照群に比べて減少(MMS処理群の1、2週を除いて はなかった。タマネギ処理群においては黄体数、着床数、生存着床数、着床前死卵数(pre- implantation egg loss)=黄体数-着床数、さらに死亡着床率に比して何ら有意の減少は認めら れなかった。なお、着床前死卵数についてはFreeman-Tukey変換(√x+√x ̄+ ̄1 ̄)した数値 について統計処理した。したがってタマネギの凍結乾燥試料の優性致死誘発効果は認められなか った。一方MMS処理群では1~3週において高い優性致死誘発効果を認めた。なお2週においては妊 娠雌が1頭であり、投与量が若干高すぎたきらいがある。
今回の試験に用いたタマネギの投与量8000mg/kgは、凍結乾燥によって重量が10%に減少すると して、50kgのヒトがタマネギ4kgを摂取した量に相当する。なおこの投与量は、試料を蒸留水中に 懸濁して胃ゾンデを用いて投与する場合における最高可能量であった(なおマウスでの1回の経口 投与量は1ml/mouseが限度である)。
以上のようにタマネギの凍結乾燥試料を用いて優性致死試験を行った結果、照射、非照射群と も優性致死効果の誘発は認められなかった。
 |
 |
 |
 |
 |
 |
 |
 |
15Kradのガンマ線照射を行ったタマネギについて遺伝毒性試験を行った。
今回の一連の試験において、細菌による突然変異性試験と染色体異常試験とについては若干の限 性を疑わせる結果が得られたが、照射群と非照射群との間にはほとんど差が見られなかった。また マウスの生体を用いる宿主経由試験および優性致死試験については照射・非照射両検体とも陰性の 結果を示した。