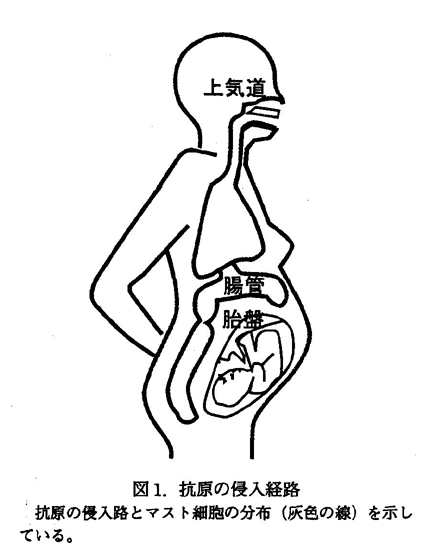
図 1. 抗原の侵入経路
 |
7. 各照射食品の最近の研究
7.1 照射卵
7.2 牛乳とその加工品
7.3 小麦
7.4 エビ
照射によって生じる食品中のタンパク質の変性は古くから知られている。当時はタンパク質の構造や機能を解析するための研究方法が限られていたために、これらについて詳しい研究は少ない。食品中のタンパク質の変性はその食品のアレルギー性の変化となって現れることもある。免疫分野で使用する概念を概観し、照射食品のアレルギー関連の研究を整理し、現時点での研究成果をまとめておきたい。とはいえ、研究は緒についたばかりで、研究数は極めて限られており、照射による抗原性の変化についてその一部を紹介するに留まる。
食品が原因で起こる主なアレルギーは抗原 (アレルゲン) と数分で発症する即時型の I 型アレルギーと発症に半日以上かかる遅延型の IV 型アレルギーが関係すると言われている。照射食品と関連があるのはこのうちの I 型である。この免疫機構について概略を説明する。
この図 1 からも分かるように、抗原の進入経路は胎盤、消化器粘膜、気道、皮膚などの経路が知られている。実際にタンパク質が体内に取り込まれるときは、腸管の絨毛組織内に栄養分か抗原かを区別するシステムが存在しており、この系が未発達か正常に機能しないとき、アレルギーをおこす抗原として働く場合が多いようだ。
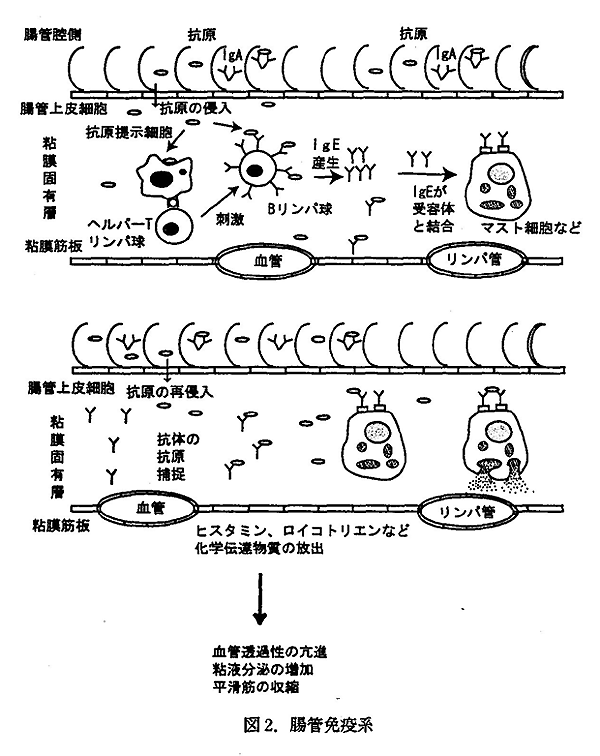
アレルギーのもとになる抗体はタンパク質で、分子量が 1 万から 10 万程度で、初めて体内に侵入したとき、異物のタンパクと判断されるとこれに対する抗体 (I 型アレルギーの場合は IgE) が作られる。2 度目以降、再び前の抗原が侵入すると、抗原は抗体−マスト細胞複合体と反応し、これによって大量のヒスタミンが放出されアレルギー症状が発現する。実際の機構はかなり複雑であるが、腸管免疫系の概略を図 2 に示した。
抗原と抗体は鍵と鍵穴のように一対一で対応しており、抗原として認識される部位のアミノ酸配列を抗原決定部位 (エピトープ) と呼ぶ。もとのタンパク質が分解しても、このエピトープ部分が残存していると、アレルギーを引き起こすと言われている。図 2 にも示したようにこのエピトープはマスト細胞に付いた 2 つの抗体に架橋してヒスタミン等の放出が起きる。この架橋に必要なペプチドの長さはおよそ分子量にして 3000 と言われている。1)
 |
 |
食べるものには多かれ少なかれ、タンパク質が含まれており、全ての食品がアレルギー原になる潜在的危険性がある。しかし、実際はすべての食品がアレルギーを引き起こすのではなく、アレルギーを起こしやすい食品は限られている。それらの食品は時代や国によって異なることが知られており、その国の食生活や子供の育て方など文化と関係があると言われている。2)
わが国におけるアレルギー性食品は卵、牛乳、小麦、そば、ピーナツ、エビなどが中心である。これらの食品はピーナツを除いて、放射線照射のターゲットとなるものである。表 1 に主なアレルギー性タンパク質を示した。卵や牛乳については昔から調べられ、そのタンパク質の性質が明らかになっている。小麦もグルアジンなどいくつかのタンパクの存在が知られているが、それらの単離には至っていないようだ。これらはいくつものサブユニットから構成されており、詳細は研究中である。しかし、エビなどはまだその正体は十分に明らかにされたとは言えない。これらのアレルギー性タンパクに共通の構造的な特徴としては、分子量は 1 万から 10 万程度、熱や酵素に安定、分子内に繰り返し構造を持つ等が上げられている。3)
 |
上述の抗体は抗原と特異的に反応するので、これを利用して微量なタンパク質を検出したり、タンパク質の性質を研究したりする分野がある。食品の安全性を確認する上でこの技術が利用されている。一つは免疫染色であり、もう一つはイライザ法である。
研究材料の抗体を得る方法は二つあって、実験で抗体を動物に作らせる方法とアレルギー患者の血清から抗体を取り出す方法がある。患者からの抗体は確実にアレルギーを誘発する抗原に対応しているが、動物に作らせた抗体はヒトアレルギーの抗原のエピトープを持っているとは限らないので、反応性の有無はヒトのアレルギーの発症の有無とは無関係であることが多い。また、どちらの抗体もポリクローナル抗体と呼ばれ、一つの抗原に対して異なった抗原決定部位を持つ複数の抗体の混合物である。通常は倫理的な問題を抱えるヒトの IgE を用いずに、ウサギや山羊に抗原を投与して、抗体を生産させ、この血清から抗体を精製して用いる。しかし、同じ動物に同じ抗原で刺激して感作しても、同じエピトープをもつ抗体が得られるとは限らない。ポリクローナル抗体とは別に、一つの抗原決定部位をもつ単一の抗体であるモノクローナル抗体と呼ばれる抗体を研究に使うこともある。これは抗原抗体反応が 1 対 1 で起きるので、この反応量と抗原のタンパクの量は比例する。ポリクローナルでも、モノクローナルでも、調べようとするタンパクの形状が一定であれば、これに対する抗体の反応性は同じと考えられている。
ELISA はどの程度の抗原が抗体と反応したかを調べる方法として開発された。分析化学の中で重要な方法となっている。しかし、マトリックスの非特異的な抗体反応が存在し、必ずしも抗原量を示さないときがある。もう一つの主要な応用はタンパクを電気泳動 (SDS-PAGE) した後、抗体を使って免疫染色して、抗原の分子量の大きさを議論するのに用いる。
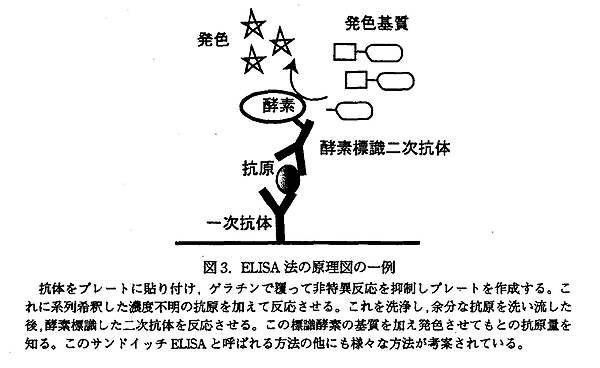 |
アレルギーのもとになるものはタンパク質なので、これの放射線化学を概観する。
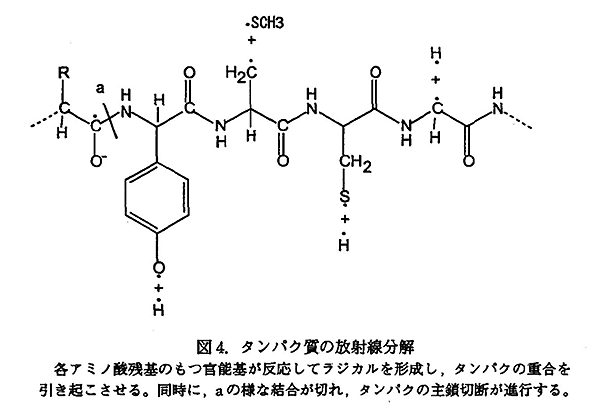
タンパク質に電離放射線が作用すると主にアミノ酸残基にある官能基が反応する。これらの反応を支配し、影響を与える条件がある。溶液の場合、その反応時の pH が等電点に近いとアミノ酸残基の分解が起こり易いことが知られている。さらに、反応温度、共存する電解質、溶存酸素量なども反応結果に影響を与えることが知られている。
アミドの炭素原子にラジカルが反応し、これから脱アミノ反応を起こしてペプチド結合が開裂する反応が起きると、タンパク質は断片化し小分子化する。
硫黄原子を含むメチオニンやシステイン残基と反応して、脱硫反応をおこし、炭素ラジカルを生成する。この活性な化学種は他の分子に反応して高分子化していくか、周りの分子から水素を引き抜いて安定な分子となる。芳香族アミノ酸であるフェニルアラニン、チロシン、トリプトファンはそのベンゼン環に水酸基が付加され、比較的安定なラジカルを形成する。これらのラジカルがクロスリンク反応を起こすとタンパク質の高分子化につながる。しかし、ヒスチジン残基は分解してアンモニアを与える。
このようにミクロ的にタンパク質の放射線分解を見ると、高分子化と低分子化が同時におきる。しかし、このような変化は焼いたり、煮たりするときの変化に比べて少ないように考えられている。一方、放射線特有の脱アミノ反応や脱イオウ反応は照射食品の風味を損なう恐れがあり、十分な注意が必要だろう。
 |
タンパク質構造のマクロ的変化を調べる方法は、粘度の変化、沈降係数の変化、酵素類の失活などがある。照射によって起きるこれらのパラメータの変化をβ-ラクトグロブリン、牛アルブミン、卵アルブミン、カゼイン等で研究された。およそ 5kGy 以上、20kGy で完全に変性がおこり、電気泳動でこれらのタンパク質は低分子化することが観察され、同時に 20kGy まで沈降定数の低下が観察された。それ以上照射しても沈降定数はさらに低下することはなかった。しかし、粘度は照射量が増えるにつれて、さらに高くなった。このことから、ペプチドは低分子化すると同時に架橋反応が進み粘性が高くなったものと推定されている。ただ、カゼインの場合はその粘度の変化から最初に小分子化した後、凝集し粘度が増大する。タンパク質の一次構造はアミノ酸残基の反応によって変化し、その骨格が変化する。どのアミノ酸が破壊されやすいかはそのタンパクの種類によって異なっているが、トリプトファンやチロシンの破壊が目立つ。照射によって生じる水和電子やヒドロキシルラジカルによって、−SS−結合や水素結合が切断され、タンパク質の二次構造も破壊される。通常このような二次構造の変化は 220nm における円偏光二色性 (Circular Dichroism、CD) の変化をとらえて判断する。一次二次構造の破壊は同時に三次四次の高次構造の破壊を招き、照射によって生じるタンパクは照射前と大きく異なった物理的化学的性質を持つことになる。照射によるクロスリンクがおこり、タンパク質は凝固し、アグリゲートを生じる場合がある。アルブミン、リゾチームなどはもとの分子量の増大が報告されている。このようなクロスリンクには共有結合のタイプとイオン強度や尿素処理等で解離する非共有結合型がある。後者の例としては血清アルブミンが知られている。
なお、初期の研究 (1958 年) として、照射牛乳のアレルギー性を検討したところ、そのアレルギー性は低下したとの報告がある。これが今回調査した中で照射食品のアレルギー性を直接調べた唯一の文献である。4)
最近は除アレルギー食品の開発研究が中心である。
鶏卵はサルモネラを除菌するために照射研究が行われた。初期の研究では、生卵だと 0.5kGy、乾燥あるいは冷凍卵だと 5kGy までは風味を損なわずに照射が可能だとしている。しかし、その後の研究では 1 から 3kGy 程度が限界との研究も見られる。液卵に対する実際的な照射としては、65℃ 前後の加熱と 1kGy 以下の照射の組み合わせによる殺菌が考えられている。このようなマイルドな条件で照射を行い、そのタンパクの免疫化学的研究を行った例は見あたらず、一般的な照射条件を用い、照射卵タンパクの免疫化学的な研究が行われている。
照射によるオボアルブミン (OVA) の構造や免疫化学的な変化が調べられた。OVA を照射し、低角散乱検出器と HPLC を組み合わせて用い、その分子量の変化を調べた。pH7.4 のリン酸緩衝液中 0.2% 溶液を 0 から 12kGy まで照射し、分子量の変化を調べた。照射時に無酸素状態では高分子化が進み、酸素存在下では若干の分子量低下が見られた。タンパク表面の変化は cis-parinaric acid とタンパクとの結合の度合いとして観察した。酸素存在下で 4kGy、無酸素条件で 8kGy まで吸収線量とともに表面の疎水性が増加し、さらに線量を増加させると疎水性は減少した。CD の測定に置いて、非照射と照射タンパクの CD 値の比は吸収線量の増加とともに減少した。これらのことから、OVA タンパクは照射によりその折り畳んだ構造が開き、さらにその表面が照射によって急速に分解されることが分かった。このようなタンパク質の構造的変化がどのように免疫化学的変化となって現れるかを調べた。まず、免疫拡散法で照射 OVA が反応するかを見たところ、酸素存在下で 4kGy、無酸素下で 8kGy まで免疫反応性が観察された。また、SDS-PAGE を行い、クマシー染色とオボムコイド (OVM) を抗原とする抗体による染色を行い比べた。クマシー染色では 2kGy 照射で OVA のバンドは消失した。一方、酸素存在下で 0 〜 2kGy 照射した OVA は低分子量領域に染色されるバンドが観察された。同様の観察は ELISA を使って観察された。加熱によっても、これら低分子化した OVA タンパクは抗体との反応性を失わないことが示されている。5)
さらに、オボムコイド (OVM) の免疫反応性の残存状態は共存するイオンの種類によって異なることが分かった。臭化カリウム、チオシアン酸カリウムを共存させて照射すると、チオシアン酸を共存させて照射した OVM は抗原性を保持していて、抗体との反応性は僅かしか低下しなかった。このことは SDS-PAGE でも確かめられた。6)
OVA の構造の一部に糖鎖がありオリゴサッカライドを形成し、OVM の熱安定性とトリプシン阻害作用をもたらしている。タンパク部分の変化だけではなく、この糖鎖部分にも照射の影響があらわれ、トリプシン阻害作用が低下することが知られている。7)
照射 OVA に対するモノクローナル抗体 5 種を用いて、照射による OVA の構造変化を調べた。これらの抗体の内 4 つは照射及び非照射の OVA と反応した。OVA03 と名付けた抗体は照射 OVA と反応するが、非照射 OVA とは反応しなかった。この照射 OVA 特異抗体のエピトープ解析を行ったところ、そのエピトープはこの OVA タンパクの内部にあるので、未変性の OVA には反応しない。しかし、通常の熱、尿素などで変性し、OVA タンパクの折りたたみ構造を解くと、この変性非照射 OVA はその照射特異抗体と反応するようになる。この点で先に説明した OVA の CD 変化と一致した結果である。真の意味合いでの照射特異の抗原性は見つかっていないようだ。8), 9)
牛乳は照射食品として最初にターゲットとして研究された。僅か 500Gy 程度の照射でも、牛乳はその色、臭いや味の点で変化するために照射が困難なものの一つであった。さらに、脱脂粉乳を 2.16kGy 照射しても、やはり典型的な照射臭がしたという。初期の研究によると、照射脱脂乳ではその粘性が増大する。また、別の研究では 27.9kGy 以下ではカゼイン、アルブミン分画が減少し、55.8kGy ではともにその分画が消失する。同時に褐変化、不溶性の増大が観察された。このようなことから高線量照射には問題があるとされている。牛乳中のアレルギー性のあるタンパクは前述のように、α-カゼイン、β-ラクトグロブリン、α-ラクトグロブリン、牛血清アルブミンなどが抗原となりうることが知られている。この中でβ-ラクトグロブリンはヒト母乳には含まれていないので、最も重要なアレルギー原と考えられている。そこで、プロテアーゼによる低分子化をおこない、アレルギー性を減少させようと試みられている。しかし、苦みなど風味の変化のために必ずしも成功していないようだ。そこで、除アレルゲン性牛乳を目指して、α-カゼイン、β-ラクトグロブリンを照射して競合阻害 ELISA 法でその免疫化学的特性の変化を検討した。抗体としては牛乳過敏患者の IgE、及びα-カゼイン、β-ラクトグロブリンに対するウサギの IgG を用いた。この患者由来の IgE は照射α-カゼイン、照射β-ラクトグロブリンを十分な抗原として認識しなかった。つまり抗原性が少なくなったといえそうだ。一方、照射α-カゼインと照射β-ラクトグロブリンそれぞれに対するウサギ IgG の結合能は吸収線量とともに増加し、さらに吸収線量を増加させて照射α-カゼインで 3kGy、照射β-ラクトグロブリンで 5kGy を超えると低下した。SDS-PAGE の結果から、照射によりこれらのタンパクは高分子化と低分子化が同時に起きて、元のバンドは 5kGy 以上で消失したという。10)
小麦は照射により大きく加工適正が変化する食品として知られている。小麦タンパクを 10kGy 照射し、ゲル濾過法で分子量を測定するとグルテン、グリアジン、アルブミンの分子量分布は低い値に変化する。同様に SDS-PAGE の結果でも、低分子化が見られた。しかし、アレルギー性との関連で研究した文献は見あたらない。
照射方法が古くから研究されている。初期の研究によると、エビは照射条件やその種類によっては褐変が起きるとされている。しかし、これを克服する技術も開発され、2.5 〜 3.5kGy 照射することが可能で、実用の段階にあると言われている。
エビのアレルギーの元はエビのトロポミオシンと呼ばれるタンパクであると考えられている。分離されているタンパクは加熱に対して安定であることが特徴で、34 〜 36kDa のタンパク質である。照射による構造的な変化を分光学的変化、蛍光染料の結合能などで調べたところ、トロポミオシンの螺旋構造は弛緩して疎水基が露出しているという。吸収線量の増加とともに、照射エビ抽出タンパクとエビアレルギー患者 IgE との反応性は減少し、その反応性は 3kGy では未照射の 50% まで減少し、さらに、10kGy では 18% まで減少したという。照射エビタンパクの SDS-PAGE でその分子変化を見ると 36kDa のバンドは 5kGy で消失する。これらのタンパクは凝固し高分子化した。これが抗原性を変化させている。照射エビ筋形質 (sarcoplasmic) タンパク分画と照射エビ筋繊維質タンパク分画に対する患者 IgE の反応性を競合阻害 ELISA で検討した。反応性は吸収線量とともに減少し、10kGy では両分画に対する反応性は 30% 以下になったという。このようなことから、アレルギーフリーのエビが供給できる可能性を示唆している。11)
照射卵の検知を免疫化学的手法で行ったという報告もある。OVA、OVM、オボトランスフェリンでウサギを抗原刺激し得られた抗体を用いて、照射卵タンパクの免疫特性を調べた。照射卵白を SDS-PAGE し、これをウエスタンブロット後これに上記の三種類の抗体で免疫染色しそのバンドを観察した。すると、30kDa 付近に照射によるバンドが観察された。これは 2kGy 照射で出現し、100℃ 15 分間煮沸しても消失しない。これらを利用すると、照射卵の検知に利用できるとしている。12), 13)
さらに、筆者らは、照射した、卵、小麦、そば、牛乳について免疫化学的な検討を行い、検知に有用か検討を行っている。その結果はいずれ報告したい。
タンパク化学と免疫化学の視点から数種の照射食品を見た。この分野の研究は少なくほとんど解明が進んでいない。古い文献は入手が困難であるが、優れた成書4), 14) 〜 17) があるので詳しくはこれらを参照して頂きたい。いずれの研究においても、タンパクのクロスリンクにより分子量が増したり、あるいは分解して低分子化するとの報告はあっても、照射によってアレルギー性が増大したとの報告は現在のところない。これは照射食品のアレルギー性を直接研究した文献が見あたらないことによる。しかし、今後照射食品が広く認められていくためにはこれら照射変性タンパクの性質や抗原性を明らかにしておく必要があるだろう。一方、食品が含有しているアレルギー性のタンパクは照射により、免疫化学的に見て、その抗原性が低下したとの報告があり、照射食品の新たな有用性を開拓する試みに、今後の発展を期待する。
貴重なご意見と文献を供与された日本原子力研究所高崎研究所 久米民和先生、文献調査に協力して下さった独立行政法人食品総合研究所 等々力節子先生に深謝します。また、免疫化学についてご教示頂いた国立医薬品食品衛生研究所 穐山 浩先生、渡邉敬治先生、宮原美知子先生に感謝します。
1) 安保 徹 : 絵でわかる免疫, 講談社, 東京, (2001).
2) 上田信男編 : 食物アレルギーが分かる本, 日本評論社, 東京, (1999).
3) 上野川修一編 : 食品とアレルギー, 朝倉書店, 東京, (2003).
4) Diehl J. F.: Safety of Irradiated Food, Marcel Dekker, New York, (1995).
5) Kume T., Matsuda T.: Changes in Structural and Antigenic Properties of Proteins by Radiation, Radiat. Phys. Chem., 46, 225-231, (1995).
6) Yang J. S., Kim J. H., Matsuhashi S. and Kume T.: Changes in Biochemical Properties of Ovomucoid by Radiation, Radiat. Phys. Chem., 48, 731-735, (1996).
7) Lee, Y. K., Matsuhashi, S., Kume, T.: Changes in Carbohydrates of Chicken and Quail Ovomucoids by Gamma Radiation, Radiat. Phys. Chem., 54, 285-290, (1999).
8) Masuda T., Koseki S. Y., Yasumoto K. and Kitabatake N.: Characterization of Anti -Irradiation -Denaturated Ovalumin Monoclonal Antibodies. Immunochemical and Structural Analysis of Irradiation -Denatured Ovalbumin, J. Agric. Food Chem., 48, 2670-2674, (2000).
9) 安本教傳 : 卵白アルブミンをモデルとした照射食品タンパク質の免疫化学的性質, 食品照射研究委員会編, 研究成果報告書, 日本アイソトープ協会, 東京, 61-78, (1992).
10) Lee J. W., Kim J. H., Yook H. S., Kang I. J., Lee S. Y., Hwang H. J. and Byun M. W.: Effects of Gamma Radiation on the Allergenic and Antigenenic Properties of Milk Proteins, J. Food Prot., 64, 272-276, (2001).
11) Byun M. W., Kim J. H., Lee J. W., Park J. W., Hong C. S. and Kang I. J.: Effects of Gamma Radiation on the Conformational and Antigenic Properties of Heat-Stable Major Mllergen in Brown Shrimp, J. Food Prot., 63, 940-944, (2000).
12) Kume T.: Immunochemical Identification of Irradiated Chicken Eggs, J. Sci. Food Agric., 65, 1-4,.(1994).
13) Kume T., Matsuda T.: Identification of Irradiated Foods by an Immunochemical Method, in "Detection Methods for Irradiated Foods", Ed., McMurray C. H., Stewart E. M., Gray R. and Pearce J., Chemical Society London, 310-316, (1996).
14) Elias P. S., Cohen A, J.: Radiation Chemistry of Major Food Components, Elsevier, (1977). (林 力丸, 斎藤和美訳 : 食品照射の化学, 学会出版センター, 東京, (1977).)
15) 伊藤均 : 食品照射の基礎と安全性, JAERIReview 2001-029, 日本原子力研究所, (2001).
16) Molins R.: Food Irradiation, John Wiley Sons, New York, (2001).
17) 山本修編 : 放射線障害の機構, 学会出版センター, 東京, (1982).
(2003 年 8 月 8 日受理)
|
|