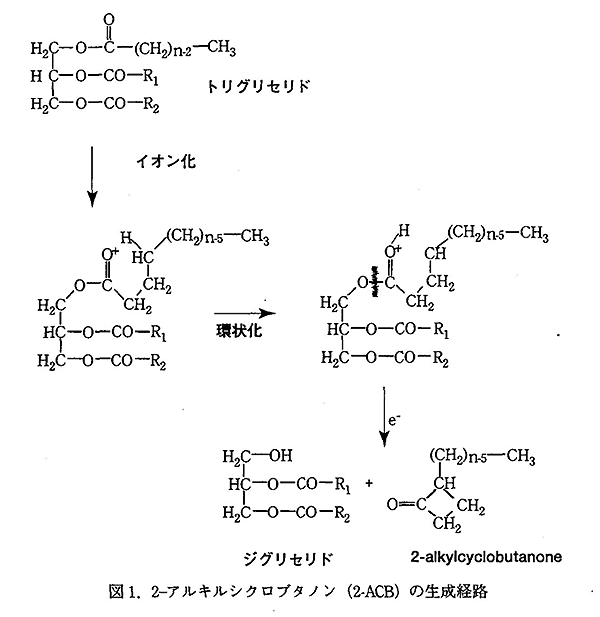
図 1. 2-アルキルシクロブタノン (2-ACB) の生成経路
 |
2. 食品中での 2-アルキルシクロブタノン類の生成とその性質
3. 2-アルキルシクロブタノン類 (2-ACB) の毒性評価
3.1 初期の研究
3.2 初期研究に対する見解 (ICFGI)
3.3 仏独グループの研究 (INTERREGⅡ)
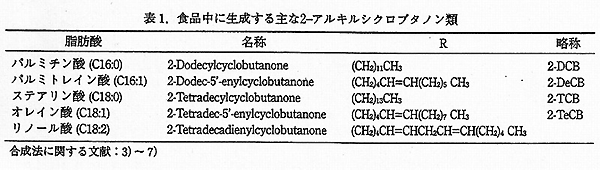
2-アルキルシクロブタノン類 (以下 2-ACB) は、食品中の脂質、トリグリセリドの分解により生成する。2-アルキルシクロブタノンの放射線による生成の可能性は、1972 年に示唆されていたが1)、実際の照射食品中での生成が報告されたのは、1990 年代に入り、照射食品の検知の研究が活発化してからである。2) この物質は、現在、放射線照射のみによって生成する放射線特異分解生成物 (Unique Radiolytic Product) とされており、その構造は、Fig. 1 に示されるように、前駆体となるトリグリセリドの脂肪酸組成に対応してアルキル基 (R) の異なるシクロブタノンが生成する (表 1)。
この物質の存在が知られる以前には、照射によって食品中に生成する放射線分解物は、非照射食品中にも含まれる成分か、他の調理加工などによっても生成が誘発される、既知の物質であるとされ、照射食品の安全性評価がなされてきた。2-ACB 類の検出により、その前提が崩れることになり、この物質の安全性評価が必要であると考えた、ドイツ国立栄養生理研究所 Delincée らが、コメットアッセイを用いて細胞の DNA 損傷の誘発を検出し、1997 年に発表したのが、安全性についての本格的な研究の始まりである。8)
Delincée らの初期の実験結果は、脂質を多く含む食品に高線量照射を施すことのリスクを警告するものとして論議をよび、その後も研究を継続した (内容の詳細は後述)。これら一連の研究成果は、Codex 食品規格の改訂における線量の上限設定や EU の許品目リストの制定作業に大きな影響を与えた。また、食品照射に反対する市民団体も、照射食品の危険性を訴えるために、彼らの論文の引用を続けており、その中には、2-アルキルシクロブタノンを含む照射食品を人間が食べることについての健康被害が、あたかも確定しているかのような短絡した記述も認められる。しかし、この物質についての評価が IARC (International Agency for Research on Cancer) のデータベースに収録されていないのをみてもわかるように、現時点で、2-ACB 類の化学物質としてのリスクが、確定していないという点を最初に強調しておきたい。また、2-ACB の純粋化学物質としてのリスクと照射食品中に存在する 2-ACB の摂取のリスクとの関係付けにも、注意が必要である。
本稿では、照射食品中の 2-ACB 類の生成や分析についての既存の研究をレビューするとともに、現在までに行われた 2-ACB の毒性試験の経緯と結果、それらに対する国際機関の見解を紹介し、照射食品の健全性評価についての理解を助けたい。
 |
 |
2-ACB を照射食品中から初めて検出し、照射の有無の判別に応用できることを報告したのは Stevenson である。2) 以来、多くの研究が重ねられ、2-ACB を指標として、照射食品の検出を行う分析法は、EU の照射食品の標準分析法 (EN1785)9) および、コーデックスの標準分析法10) として採用されている。
公定法では、食品中から脂質をソックスレー抽出した後、フロリジルカラムを用いてさらに分画精製し、2-ACB 類を GC/MS で分離検出する。最近では、炭酸ガスによる超臨界流体抽出を使って、食品から直接シクロブタノンを迅速に抽出し、GC/MS で分析する方法が多く報告されている。11) 〜 15) 検出方法としては、MS の他に TLC16) や ELISA5), 17) を利用して、定性的な判定をする試みもなされた。
公定法を適用する食品については、鶏肉 (0.5kGy 以上)、液体卵、豚肉、カマンベールチーズ、サケ肉 (1kGy 以上) について、良好なクロスチェックの結果が得られている。18), 19) Ndiaye らによれば、公定法の定量限界は、脂質含量 1% の食品に対して、0.5kGy 以上の照射の検出が可能である。27) ソックスレーによる脂質抽出と、超臨界流体抽出による精製を組み合わせ、50Gy 照射した玄米から 2-DCB を検出することが可能との報告もある。20) これ以外にも、牛肉やマンゴ、パパイア、アボガドの種子、ハンバーガーパテ、など多くの食品について分析例が報告されている。既存の報文を食品別にまとめた (表 2)。
2-ACB の生成量は、線量に依存して増加する。個々の食品中での生成量は、前駆体である脂質含量と脂肪酸組成、また、脂肪酸のトリグリセリド中での位置によっても変化するが、前駆体である脂肪酸のモル数あたりに換算すると、空気存在下、6-8℃ の照射条件では、ほぼ、1-1.6 nmole/mmole 前駆体脂肪酸となる。27) また、凍結状態の照射では生成量が若干低下する。24), 27), 35) 照射雰囲気の影響は少ないとの報告もあるが、24) 真空条件下で生成量が低下するとの報告もある。27)
放射線照射以外の食品処理によって、2-ACB が生成する可能性について、マイクロ波照射、加熱、UV 照射、超高圧処理、超音波処理などが検討されたが、いずれも否定された。21), 27)
食肉中の 2-ACB 類の貯蔵安定性について、Crone らは鶏肉を 4℃ 18 日貯蔵した場合の 2-DCB の減少は 15% 程度との報告している。21) また、Ndiaye らは、照射鶏肉の 4℃、1 ヶ月貯蔵後の 2-TCB の損失率は、48%、2-TeCB は、52% と報告している。27) Stewart らは、4℃ 保存のカマンベールチーズ中の 2-DCB 及び 2-TCB の損失率は 26 日で 10% 程度、マンゴを 10℃ 14 日貯蔵した場合の 2-TCB 及び 2-TeCB の損失率は、7% および 23% 程度であるのに対し、パパイアでは、10℃、7 日の貯蔵でも 2-DCB 及び 2-TeCB は 80 〜 60% が消失してしまうと報告している。35) 何れの報告においても揮発性の高い炭素数の少ない脂肪酸由来の 2-ACB のほうが、損失率が大きい。
なお、米国で行われた照射鶏肉の長期投与試験で用いられたサンプル中の 2-ACB の存在も確認されている。22) 毒性試験は、米国陸軍が Raltech に委託して 1976 年から 1984 年までに実施し、鶏肉照射試料のほ乳類への毒性影響は無いとの結論を得て、Thayer らが 1987 年に報文にまとめている。39) 毒性実験に際し、USDA の東部研究所で、3 種類サンプルが調整され、常温で保存された ; ①加熱処理 (1978 年、缶詰) ②電子線照射 (1979 年、平均線量 58kGy、-40℃、真空包装) ③ガンマ線照射 (1979 年、平均線量 57kGy、-40℃ 缶詰。) Crone らがこれらを 1991 年に分析したところ、コントロールの加熱処理サンプルからは、2-ACB 類は検出されなかったが、照射鶏肉サンプルでは、12 年の貯蔵期間を経ても、2-DCB 及び 2-TCB が検出された。ただし、新たに鶏肉を凍結状態 (-46℃) で照射し、2-DCB の生成量 y (μg) と、線量 x (kGy) の関係を求めた結果 ; y = 0.336X と比較すると、毒性試験に用いられた照射鶏肉中の 2-DCB は、12 年間で 50% ほど低下していた。また、動物への feeding test を想定し、鶏肉を凍結乾燥して分析すると、2-DCB の 60% が消失した。いずれにしても、毒性試験に供した照射鶏肉中の、2-ACB の存在が証明された。
2-ACB 類は、調理による加熱では、簡単に分解しない。加熱による損失は認められるものの、表 2 中にも示した様に、照射した液体卵を原料にしたケーキ類や、加熱調理した鶏肉、牛挽肉パテなどにおいても、2-ACB の検出が報告されている。
 |
Delincée らの初期の研究では、2-DCB について① in vitro の試験 (コメットアッセイによる遺伝毒性とヒト結腸培養細胞を使った細胞毒性試験)40) と、② 2-DCB 投与ラットを使った in vivo 試験 (コメットアッセイおよび細胞毒性試験)41) とが行われた。これらの試験については、実験方法に対する疑問も投げかけられたため、1999 年から 2001 年にかけて、フランスのルイ・パスツール大学とドイツの栄養生理研究所 (BFE) のグループが、EU と地方行政から研究費の助成を受け、毒性試験のプロジェクト研究 (INTERREG Ⅱ ③ 〜 ⑨) を実施した。42) これらの概略を表 3 にまとめた。
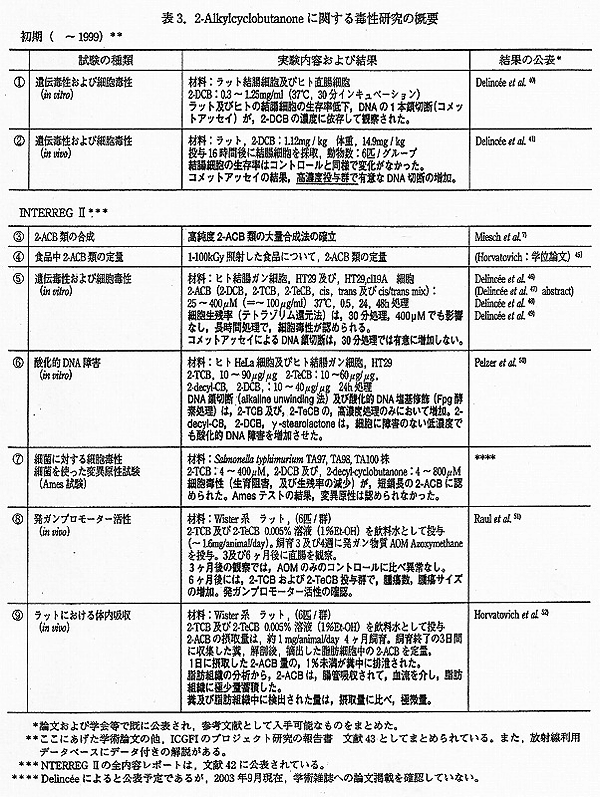 |
Delincée らが行った初期の研究では、北アイルランド、ベルファーストの MacMurray を通じて、Queens University の研究グループが合成した 2-DCB を利用した。
ラットおよびヒトの結腸細胞を動物から採取し、2-DCB 溶液 (0.3 〜 1.25mg/ml) 中で 30 分間処理した後、細胞の生残率を Tryptan blue 排斥法で、DNA の 1 本鎖切断をコメットアッセイによって測定した。その結果、2-DCB の濃度に依存して、生存率の減少、DNA 鎖切断の増加が観察された。また、ヒト細胞の方がラット細胞より感受性が高かった。この結果について、Delincée は、実験に用いた濃度が極めて高いこと、Raltech で行った動物試験では、悪影響が認められないこと39) を指摘して、2-DCB のリスクの可能性は低いレベルであると、結んでいる。
2-DCB を 2 段階の濃度でラットに投与し、16 時間後に結腸細胞を採取して、細胞の生残率と DNA 鎖切断の測定を行った。この時の投与量は、低用量 : 1.12mg/kg 体重、高用量 : 14.9mg/kg に設定した。2-DCB は 2%DMSO を含む、生理食塩水に 5ml/kg 体重になるように溶解し、negative コントロールは、2%DMSO 生理食塩水、positive コントロールとして、15mg/kg の 1,2 ジメチルヒドラジン (DMH) 水溶液を投与した。使用した動物の数は、2-DCB 投与群は各 6 匹、コントロール群では各 3 匹である。その結果、細胞の生残率は、negative コントロールと 2-DCB 投与群との間で差がなく、細胞毒性は認められなかった。コメットアッセイによる DNA 鎖切断の検出では、低用量投与群の 6 匹のうち、2 匹のラットから摘出した細胞で、コントロールに比べて DNA 鎖切断の増加が観察され、高用量投与群では、6 匹すべてがコントロールに比べて高い DNA 損傷度を示した。統計的には、高用量投与群のみが、コントロールに比べて有意差を生じた。ただし、この場合でも DNA 損傷の程度は、positive コントロールの DMH に比べて小さかった。
この時の 2-DCB の投与量は、それぞれ殺菌 (3kGy) と滅菌 (60kGy) 線量を想定して算出したとしている。Delincée によれば、3kGy の鶏肉 (生) の殺菌で生成する 2-DCB の量を 1.5μg/g 脂質とする。2-DCB の前駆体となるパルミチン酸は鶏肉脂質を構成する脂肪酸の 1/5 であるから、鶏肉中に生成するシクロブタノン類の総量は、その 5 倍量と概算する。同時に、ヒトが消費する脂質の全てが照射されていると仮定すると、成人の 1 日平均の脂質の摂取量は体重 1kg 当たり 1.49g/kg BW であるから、2-DCB 量に換算すると 1.5μg × 5 × 1.49 = 11.2μg/kg BW と算定される。安全係数として、個体差に関して 10、さらに種間の違いを (ここではラットとヒト) 考慮した係数 10 を乗じて、殺菌時に期待される NOEL (最大無作用量) を設定した ;
11.2μg × 10 × 10 = 1.12 mg 2-DCB/kgBW
同様に 60kGy 照射した凍結鶏肉に期待される NOEL として、Crone らの分析結果22) に基づいて、2-DCB の生成量を約 20μg/g 脂質として計算を行うと、
20μg × 5 × 1.49 × 10 × 10 = 14.9 mg 2-DCB/kgBW
Delincée は、この研究報告の discussion に、高濃度レベルの 2-DCB の投与が、有意な DNA 鎖切断を誘発するが、結果の解釈の上では、全ての DNA 損傷が、ガンの発生や、発ガン関連遺伝子の変異につながるものではなく、DNA 修復や、アポトーシスなどの細胞内機構の発現も考慮にいれるべきであると指摘している。あわせて、この実験で用いた 2-DCB の量が極めて高く、ヒトが 14.9mg/kg 体重の 2-DCB を摂取するには、60kGy 照射したブロイラーを 800 羽以上消費することになると指摘している。また、ここでも Raltech の動物実験の結果39) にも触れ、照射食品中の 2-DCB の摂取リスクは、非常に低いレベルに違いないが、さらに研究が必要と結んでいる。
1999 年 10 月に行われた、第 16 回 ICGFI 年次大会では、前年の総会で投げかけられた、Delincée の研究結果に対する疑問を受け、WHO の代表が毒性学の専門家 3 人に依頼した初期研究についてのレビュー結果が報告された。ここでは、コメットアッセイの試験法としての妥当性に関する見解が結果の解釈における重要なポイントとして示された。
FDA の Benz は、規制のための安全性評価にコメットアッセイ法を用いるのは、(レビューを依頼された 1998 年 11 月の時点で) 時期尚早であり、アッセイ法のプロトコールの標準化と、より多くの化学物質についての試験結果の集積による信頼性の確認が必要と述べている。また、McGregor も、DNA コメットアッセイでは、発ガン物質を高感度に検出できることが示されているが、非発ガン性や、発ガン性が非常に弱い物質についての試験結果が不十分 (false positive の頻度が検証できていない) とコメントしている。また、Delincée の in vivo 実験で認められた DNA 損傷は、その程度が低いこと、動物への投与濃度が、ヒトが照射鶏肉を食べた場合に換算すると極めて大きく、Ames 試験の結果と併せて考えると、2-DCB に遺伝毒性があるとする結論は適当でないとの判断を示した。また、Sapora は、DNA コメットアッセイは、一般的には DNA 損傷を調べるために用いられており、細胞の遺伝的性質を最終的に変えてしまうことを意味する遺伝毒性効果 (genotoxic effect) の検出には適当ではない。DNA コメットアッセイで検出される、1 本鎖切断 (ssb) は、迅速に修復されるので遺伝毒性効果の発現に至るような、生物学的に安定な変化や決定的な損傷を与えないとコメントしている。
また、このときの ICGFI の年次大会では、早期に行われた、Ames 試験の結果が、MacMurray を通して紹介された。これは、1992 年に、MacMurray ら北アイルランド農務省の依頼を受けたルーバンカトリック大学の研究者が予備的に行ったもので、ICGFI の事務局が毒性評価試験のための 2-DCB の入手可能性を問い合わせた時に、その存在が明らかになった。具体的なデータをみることはできないが、ICGFI の総会資料によると、ヒスチジン要求性 Salmonella typhimurium TA98 および、TA100 株を用い、S9mix の存在及び非存在下で、最高 1000μl/plate までの 2-DCB を用いておこなった試験結果では、代謝活性化法 (S9mix を添加した場合) の如何を問わず、復帰突然変異性は認められなかったとしている。Ames 試験の結果が、陰性であるという事実は、非常に大きな意味を持っているが、この報告では、2-DCB の正確な濃度が不明なのは残念な事である。
なお MacMurray は、Delincée に提供した、シクロブタノンの純度は 99% と推定されるが、試薬の取り扱いが不適切であると、酸化によりラクトンに変換される可能性もあることを指摘している。
Delincée らは、これらのコメントに対し、彼らは規制・基準の判断を下すためにコメットアッセイの結果を提示したのではなく、コメットアッセイをリスク評価に用いるのは、時期尚早で、完全なリスク評価のためには、より多くの試験研究が必要であると言う見解に賛成であると述べている。
以上のような経緯で、2-ACB 類に関する毒性評価研究の継続が必要と考えた、Delincée らドイツ国立栄養生理研究所およびフランスのルイ・パスツール大学の Marchiori らによる研究グループは、1999 年から 2001 年にかけて、2-ACB 類の毒性に関する新たな試験を実施した。この結果は、2001 年 11 月に報告書がまとめられ、研究費のスポンサーに提出された。同時に、2002 年 2 月にブリュッセルで行われた、EU の SCF の GMO と新規食品に関する合同ワーキンググループ会議で報告された。44)
一連の研究では、新たな合成法を開発し、純度の高い 2-ACB 類 (飽和 : 2-decyl-, 2-undecyl-, 2-dodecyl-, 2-tetradecyl- 不飽和 : 2-dodecenyl-, 2-undecenyl-,2-tetradecenyl-cyclobutanone) 及び、その誘導体のラクトン (γ-stearolactone) を g 単位で効率的に合成した。また、オレイン酸からの誘導体である 2-tetradecenyl-cyclobutanone については、cis、trans 異性体の分離精製もおこなった。これにより高純度品による毒性試験の実施を可能にした。(③)
また、照射によって生成する 2-ACB の定量を、粉ミルク、ヘーゼルナッツ、鶏肉、牛肉、フォアグラ、ココア、ハンバーガー、スモークサーモン、カエル肉、鶏肉団子、サケ、アボガド、液体卵について行った。線量は、1、3、5、10、30、50、100 kGy、照射温度は 6-8℃ であった。その結果、生成する 2-ACB の量は、広範囲にわたって、線量依存的であり、シクロブタノンの側鎖の種類は、それぞれの食品の脂肪酸組成に依存した。(④)
なお、このレポートの中で、Marchioni は、鶏肉中の 2-ACB 量の推定を行っている。殺菌線量 (3kGy) における 2-ACB の生成量は、鶏肉の脂質含量を 10% とすると、0.4μg/g 鶏肉 (調理後) と算定され、成人 (70kg) が 200g の鶏肉を一度に摂取すると仮定するとその摂取量は、約 80μg となる。従って、体重 1kg あたりに換算すると、1μg の 2-ACB 類が殺菌線量の鶏肉から摂取されることになる。同様に、Raltech の行った、高線量照射鶏肉 (58kGy) の長期動物投与試験の食餌に含まれるシクロブタノン類の量については、2-DCB の生成量を脂質 1g、1kGy あたり 0.3 μg/脂質、動物に投与した食餌中の鶏肉の割合が乾燥重量で 35%、鶏肉の脂質含量を鶏肉 1g あたり 12.5%、鶏肉を凍結乾燥する際の 2-DCB の損失を 60% として推定すると、動物の食餌 1g あたりでは、
0.3 × 58 × 0.125 × 0.35 × 0.4 = 0.3 μg/g diet
2-ACB の総量については、パルミチン酸の組成を 20% とすると、1.5μg/g diet と算出される。Raltech の動物実験で摂取量は、体重 30g の動物が 5g の食餌を摂取したとすると、体重 1kg あたりの 2-ACB 消費量は、250μg/kg B.W、体重 500g のラットが 20g の食餌をとるとすると、60μg/kg B.W と算出される。
合成された 2-ACB 類については、表 3 の⑤ 〜 ⑧に示した様な毒性試験が行われた。順を追って、詳細を説明する。
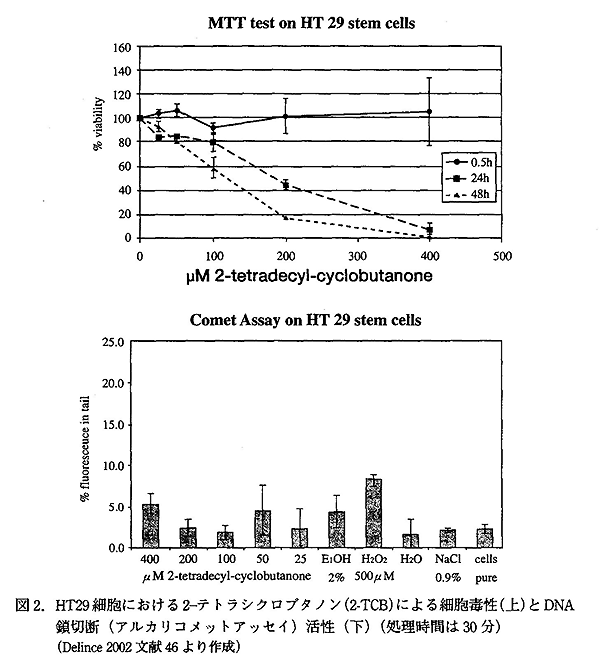
Delincée らはヒト培養ガン細胞 (ヒト結腸細胞 HT-29 幹細胞及び、HT-29、クローン 19A 細胞) を用い、細胞毒性 (テトラゾリウム還元試験による細胞生存率の測定) と、遺伝毒性 (コメットアッセイ) を検討した。細胞を 400μM までの濃度の 2-ACB 類 (2-DCB、2-TCB、2-TeCB、cis、trans、cis/trans 85/15 mix) またはγ-stearolactone 溶液中でインキュベートし、生存率を調べると、短時間 (30 分) 処理では、何れの化合物も影響も示さなかった。また、短時間処理では、コメットアッセイによる 1 本鎖切断の有意な増加は、観察されなかった。細胞を長時間にわたって処理した場合には、実験に供したすべての化合物が、高濃度において (たとえば、2-TCD では、>50μM) 生残率の減少をひきおこした。(図 2)
 |
Pelzer らは、ヒト HeLa 細胞及び、ヒト結腸ガン細胞 HT29 を用いて、Alkaline unwinding 法による DNA 鎖切断を行った。また、Alkaline unwinding 法に細菌 formamidopyrimidine-DNA glycosylase (Fpg) 酵素処理を組み合わせて、酸化的 DNA 塩基修飾の検出を行った。Fpg は、8-oxoguanine などを含む塩基修飾を認識して、DNA 切断を行うエンドヌクレアーゼであり、Fpg 酵素処理によって増加する DNA 鎖切断は、DNA 塩基の酸化的障害の可能性を示唆する。実験には、2-TCB、2-TeCB、2-DCB、2-decyl-cyclobutanone (C10 の飽和シクロブタノン) と、2-TCB の分解生成物、tetradecyl-γ-butirolactone (γ-stearolactone) を、90μg/ml までの濃度の 2% エタノール溶液とし、細胞を 24h 処理して影響を検討した。同時に、細胞のコロニー形成能を測定した。その結果、2-TCB および、2-TeCB の処理では、細胞膜の正常な構造が破壊され、細胞のコロニー形成能が完全に失われる様な高濃度 (2-TCD で 70μg/ml、2-TeCBで50μg/ml) においてのみ、DNA 鎖切断の増加と、酸化的 DNA 塩基修飾の増加が認められた。これに対して、2-DCB では、細胞のコロニー形成能が低下しない 10-30μg/ml の処理でも、酸化的 DNA 障害の増加が認められた。(図-3) 2-decyl-cyclobutanone でも同様に酸化的 DNA 障害の増加が認められた。また、γ-stearolactone では、HeLa 細胞、HT29 細胞の両方において、酸化的 DNA 障害の増加が顕著に認められた。
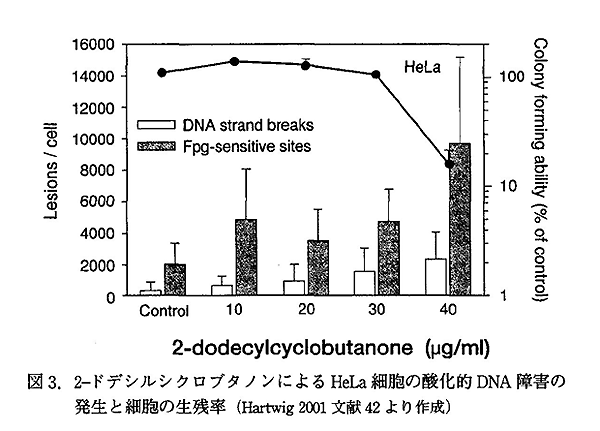 |
Burnouf らは、Salmonella typhimurium TA97 株を用い、3 種の飽和 2-ACB (2-TCB、2-DCB 及び、2-decyl-cyclobutanone) の細胞毒性 (生残率および、培養液に添加した際の増殖速度の測定) の検討と、Salmonella typhimurium TA97、TA98、TA100 株を用いた変異原性試験を行った。
その結果、4μM 以上の 2-decyl-cyclobutanone、40μM 以上の 2-DCB の培養液への添加は、S. typhimurium TA97 株の増殖速度を低下させたが、400μM の 2-TCB は、ほとんど影響が無かった。また、S. typhimurium に対する死滅効果も同様の傾向が認められ、炭素数の短い 2-decyl-cyclobutanone が強い毒性を示した。
一方、Ames 試験の結果では、代謝活性化の有無によらず、実験に用いた 3 つの菌株の復帰突然変異によるコロニー形成数の有意な増加は認められなかった。また、ポジティブコントロールとして用いた、2-Aminofluoren (2-AF) は、陽性の結果を示した。 (表 4)
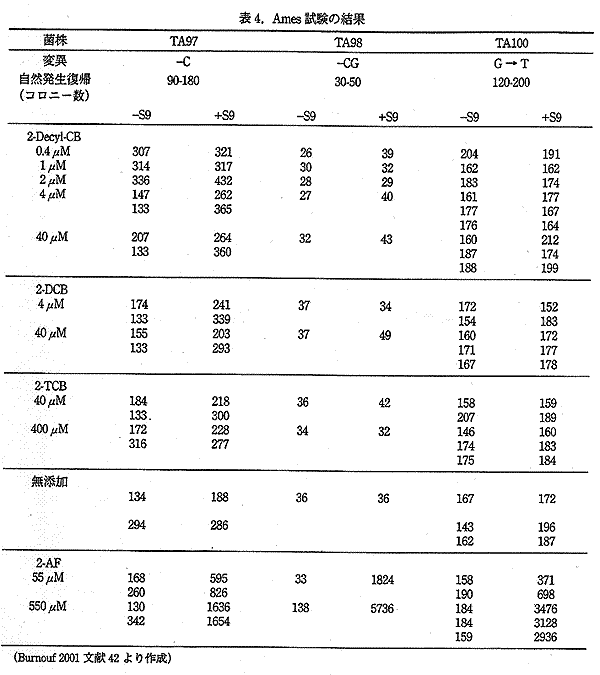 |
Raul らは、ウィスター系ラット、各群 6 匹を実験用混合試料で飼育した。飲料水として、0.005% (wt/vol) の 2-TCB および 2-TeCB (1% エタノールに溶解) を用事調製して毎日午後 5 時に与えた。コントロールは、エタノール溶液のみを与えた。1 日あたりの 2-ACB の平均的な摂取量は、ラット 1 匹に対して、1.6mg 程度であった。2-ACB 摂取開始、2 週間後、(実験開始、3 週および 4 週目に) 2 回にわたって、化学発ガン物質である azoxymethane (AOM) 15mg/kg BW をすべての群の動物に投与した。AOM は、ラット結腸に、前ガン状態の障害 (異常クリプト : aberrant Crypt = AC の発生)、腺腫、腺ガンを誘発する。AOM 投与後、3 ヶ月および 6 ヶ月間飼育を続け、解剖して結腸末端の腫瘍の発生 (前ガン状態および結腸粘膜に到達する腫瘍の大きさと個数) を観察した。
投与実験の期間において、2-TCB および 2-TeCB 投与群と AOM コントロール群での体重増加量に差は認められず、高線量照射鶏肉の動物実験の結果39)と同様に、急性毒性は示されなかった。
AOM 投与 3 ヶ月後の前ガン状態を示す障害の程度は、2-TCB または 2-TeCB 投与群と AOM コントロール群との間で差が認められなかった。一方、AOM 投与 6 ヶ月後には、異常クリプトの総数が、2-TeCB 投与群で有意な増加を示し、前ガン状態の障害の促進が認められた。腫瘍の発生は、6 ヶ月飼育群のみに観察され、2-ACB を摂取した動物群に発生した腫瘍の総数は、AOM コントロールの動物に比べ 3 倍増加した。AOM コントロール群では、6 匹中 4 匹の結腸に小さい腫瘍 (〜 6mm3) が発生したのに対し、2-TCB 摂取群では 6 匹中 4 匹、2-TeCB 摂取群では、6 匹中 3 匹の動物の結腸に複数の腫瘍が発生した。中程度 (6 < S < 25mm3) および、大きい (> 25mm3) 腫瘍の発生は、2-ACB 投与群のみにおいて認められた。(図 4)
これらの実験から 2-ACB 類 (2-TCB および 2-TeCB) は、それ自身が発ガン物質として働くのでは無いが、化学物質による大腸ガンの発生を促進するプロモーター活性を有している、と結論づけられた。この事実は、純粋な 2-ACB 類について初めて確認されたが、この結果を、照射食品をヒトが摂取する場合のリスク評価に適用する妥当性ついては、さらに検討が必要である。Raul らは、この実験におけるラットの 2-ACB の 1 日の摂取量は、体重あたりにすると 3.2mg/kg BW であり、ヒトが、照射食品を食べた時に、想定される摂取量 ≤ 5-10μg/kg BW と同等ではない。また、食品中には、2-ACB の吸収を阻害する成分が存在する可能性を指摘している。
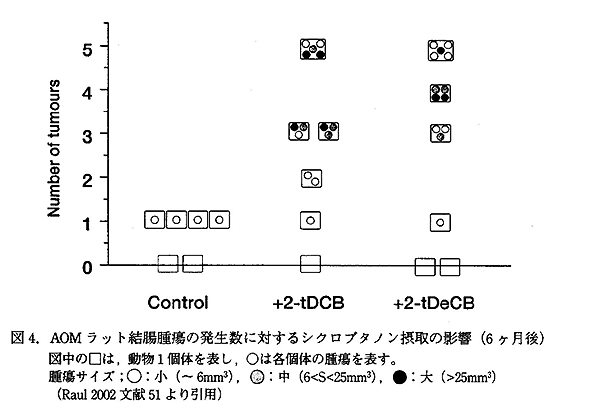 |
Horvatovich は、上記⑧と同様に、飲料水に 0.005% の濃度で溶解した 2-TCB および、2-TeCB を 4 ヶ月間ラットに摂取させ、糞中、および脂肪組織中に回収される 2-ACB 類の定量を行った。ラット糞は、実験終了期間の最後の 3 日間に集められ、脂肪組織は、解剖摘出した。何れも分析に供するまで、-80℃ で保存し、ソックスレー抽出した脂質をフルオリジルカラムをトラップにした超臨界抽出で前処理し、GC/MS による定量を行った。分析結果を表 5 に示す。
コントロール群の糞および脂肪組織では、いかなる 2-ACB も検出されず、食餌中からのコンタミネーションがないことが確認された。また、2-TeCB 摂取ラットの脂肪組織と糞からは、2-TeCB のみが検出され、2-TCB 摂取ラットでは、2-TCB のみが検出された。
2-TCB と 2-TeCB のラットによる摂取量はほぼ同じであったが、脂肪組織から検出された量は、飽和の側鎖を持つ 2-TCB の方が 4 倍ほど大きく、不飽和の 2-ACB である 2-TeCB の蓄積量のほうが少ないか、ラット体内での代謝速度が速いのかのどちらかと推察される。脂肪組織への蓄積が認められたという結果から、2-ACB は、腸管のバリアーを通過して血流に入り脂肪組織へ蓄積することが明らかになった。なお、ラット体内の脂肪量を 30g と仮定すると、毎日 1mg の 2-ACB 類を 4 ヶ月摂取したラットの脂肪組織への蓄積量は 2-TCB は 9μg 、2-TeCB は 2μg と推定され、摂取総量にたいする蓄積量は、1/105 と極めて低いことになる。
糞中からの検出量も極めて少なかった。ラットの 1 日あたりの糞の排泄量を 3g とすると、2-TCB 3μg 、2-TeCB 1.5μg が糞中に排泄されたことになる。これは、ラットが毎日摂取した 2-ACB 量に対して、0.1-0.3% にすぎない。これらの結果から明らかなように、ほとんどの 2-ACB は他の組織に蓄積したか、速やかに代謝されたことになる。2-ACB の生体内での代謝動態については、さらに検討が必要である。なお、この実験においても、コントロールの動物と 2-ACB 摂取動物との間で、飼育期間中の体重増加の差は認められなかった。
 |
プロジェクト全体の結論として、"これらの実験では、2-アルキルシクロブタノン類の純品が、ラット結腸ガンに対する発ガンプロモーター活性を含む、毒性効果を持つことを明らかにした。しかし、Ames 試験の結果では、変異原性は観察されなかった。これらの知見が、ヒトに適用できるかは、慎重に考慮する必要がある。脂質を含む照射食品に起こりうるリスクの解明には、他の研究グループによる追試も含めた、さらなる研究が必要である。" と結んでいる。
EU の SCF は、2002 年 7 月に上記の研究レポートに対する公式見解を発表した。53)
この見解の中では、上記のプロジェクト研究に対して、プロモーター活性の発現が、発ガン物質の投与 23 週間後であったこと、Ames 試験の結果が陰性であったこと、哺乳動物細胞を使った、in vitro の遺伝子変異や染色体異常の試験が行われていないこと、標準的な Feeding 試験が実施されていないことが指摘された。
そして、現在のところ、2-ACB の遺伝毒性は標準的な毒性試験法によって確立されてはいないし、各種 ACB 類に対する NOAEL (no-observed-adverse-effect-level) を定めるための適切な動物実験結果も存在せず、上記の研究グループによって行われた in vitro 試験のほとんどにおいて 2-ACB の悪影響が認められたが、これらの結果から、脂質を含む照射食品中の 2-ACB 類をヒトが摂取することの健康リスクを評価することは適当でないと結論した。
そして、脂質を含む照射食品の安全性に関しては、これまでの SCF の考え方を踏襲し、照射食品を使って行われた、多くの動物実験に基づいて WHO/FAO/IAEA が 1981 年に下した、健全性についての評価結果* や、"適性な条件下における照射処理は安全である" とする 1986 年の SCF における見解** を再確認する。としている。
また、WHO が 2003 年 3 月に表明した見解54) は、以下の様なものであった。
照射食品中の生成量は極めて少なく (G 値 0.001)、さらに食品中での安定性も考慮すると、食品中から摂取される 2-ACB の量は、生の食品中の分析値より低い可能性がある。
1997 年の FAO/IAEA/WHO の高線量照射に関する Study Group の判断*** においては、食品中の微量の 2-ACB の存在も考慮した上で、1970 年代のラルテックによる照射鶏肉 (59kGy : -30 度、照射で生成する 2-DCB は 1.7μg /g 鶏肉 (生重量)) に関する毒性試験の結果に基づいた判断を下している。この研究では、長期毒性試験、催奇形性試験や一連の in vitro 試験で、照射鶏肉の毒性を示す結果は得られていない。これらの研究の感度の限界を考慮しても、シクロブタノン類の毒性は、たとえあったとしても極めて低いか、無視できる程度と判断できる。
Delincée らの初期の研究に対しては、試験に使用した CB の取り扱いの妥当性の問題と、コメットアッセイの毒性試験としての妥当性 (ビタミン C も含め False positive の例があり、多くの毒性学の専門家は、その精度が検証されていないと判断し、規格基準の判断には、もちいられていない) の問題点を指摘した。
フランス-ドイツのグループの再実験に関しては、限られた研究結果によって、2-ACB が健康危害をもたらすとの結論を出すのは時期尚早と解釈している。この実験では、精製した純粋な 2-ACB を使用し、毒性試験にエームス試験が取り入れられた。エームス試験により変異原性は否定されたにも関わらず、法的に確立されていない試験方法によって得られた結果で、2-ACB がガン発生の可能性を示し、実験を行った著者らは、試験結果をヒトにあてはめることの妥当性については、慎重な考慮が必要と結論している。と批判的な見解であった。
最近のレポート52) における動物体内での 2-ACB の代謝実験の結果については、2-ACB を 4 ヶ月間、摂取した動物の体重増加がコントロールと同様であったことを指摘した。また、脂肪組織への 2-ACB の移行は、摂取量の 0.002-0.008% であり脂肪組織に蓄積しているとは言えない。また、糞中への排泄は 0.1 〜 0.3% であり、シクロブタノン類は、ラット体内で迅速に代謝されるか分解されているかのどちらかであると推察される。との解釈を示した。
結論としては、「長期間の動物実験と Ames 試験がネガティブという結果を含む、現時点での科学的証拠に基づいて、2-DCB および 2-アルキルシクロブタノン類は消費者の健康リスクを損ねないと判断する。WHO はこれまで、FAO/IAEA/WHO の専門家グループや各国各地域の専門家によって導き出された "照射食品は、安全で、栄養学的にも適合性がある" という結論に疑問を挟む様な論拠は持っていない。」
なお、WHO はこの見解を結ぶにあたり、この化合物の毒性 / 発ガン性について残された不確定要素の解明のための研究の実施をすることを引き続き奨励して行くこと、照射食品に関し、公衆の健康に対するリスクの可能性を示すような新たな証拠が指摘された場合には、照射食品のリスクアセスメントを再開する意志があることを、再度表明している。
以上、2-ACB の毒性研究に関して、研究の経緯と内容について、オリジナル文献の所在を明らかにしながら、実験結果を交えて紹介してきた。筆者自身は、毒性学の専門ではないので、できるだけ論文内容に忠実な記述になるように努め、研究結果の解釈については、WHO や SCF の文書の紹介に留めた。そのため、文章全体が長くなってしまったことをお詫びしたい。
本稿の執筆にあたり、文献資料を提供して頂いた、ドイツ国立栄養生理研究所の Dr H. Delincée、IAEA の Dr P. Thomas、日本原子力研究所伊藤均先生および久米民和先生に感謝いたします。
1) LeTellier M. H. and Nawar W. W. : Lipids, 7, 73-76, (1972).
2) Stevenson M. H. et al. : Nature, 344, 202, (1990).
3) Boyd D. R. et al. : J. Agr. Food Chem., 39 (4), 789-792, APR (1991).
4) Crone A. V. J. et al. : J. Sci. Food Agr., 62 (4), 361-367, (1993).
5) Hamilton L. et al. : J. Chem. Soc. Perk. T., 1 (2), 139-146 (1996).
6) Miesch M. et al. : Radiat. Phys. Chem., 55 (3), 337-344 (1999).
7) Miesch M. et al. : Radiat. Phys. Chem., 65 (3), 233-239 (2002).
8) Delincée H. and Pool-Zobel B. L. : Genotoxic properties of 2-dodecylcyclobutanone, a compound formed on irradiation of food containing fat, Poster presented during the 10 International Meeting on Radiation Processing, Anaheim., CA (USA) 11-16 May (1997). (Abstract published in Conference Program and Abstracts, p. 68, 1997).
9) Europian Comittee for Standardization : Foodstuffs, Detection of irradiated food containing fat, Gas chromatographic/mass spectrometric analysis of 2-alkylcyclobutanones EN 1785 (1996).
10) General Codex Methods for the Detection of Irradiated Foods : Codex Stan. 231 (2001).
11) Gadgil P. et al. : J. Agr. Food Chem., 50 (20), 5746-5750 (2002).
12) Stewart E M. et al. : J. Aoac. Int., 84 (3), 976-986 (2001).
13) Horvatovich P. et al. : J. Chromatogr. A., 897 (1-2), 259-268 (2000).
14) Tewfik I. H. et al. : Food Sci. Technol. Leb., 31 (4), 366-370 (1998).
15) Tewfik I. H. et al. : Int. J. Food Sci. Nutr. 50 (1), 51-56 (1999).
16) Rahman R. et al. : Food. Res. Int., 29 (3-4), 301-307 (1996).
17) Elliott C. T. et.al. : Analyst, 120 (9), 2337-2341 (1995).
18) Stevenson M. H. : Validation of the cyclobutanone protocol for detection of irradiated lipid containing foods by interloboratory trials, In Detection Method for Irradiated Foods-Current Status, Edited by McMurray C. H. et al. Royal Socity of Chemistry, Cambridge UK, 269-284 (1996).
19) Stevenson M. H. et al : Aeuropean Collaborative Blind trial using 2-Dodecylcyclobuanone and 2-Tetradecylcyclobutanone to Detect Irradiated Chicken, Pork and Liquid Whole Egg, FAO /IAEA Report, Viena Austria (1994).
20) Lee H. J., et al : J. Food Sci. Nutr., 4, 270-275 (1999).
21) Crone A. V. J. et al : J. Sci. Food Agr., 58 (2), 249-252 (1992).
22) Crone A. V. J. et al.: Int. J. Food Sci. Tech., 27 (6), 691-696 (1992).
23) Steevenson M. H. : Trand in the food Science and Technology, 3, 257-262 (1992).
24) Stevenson M. H. et al.: Radiat. Phys. Chem., 42 (1-3): 363-366 (1993).
25) Steevenson M. H. : Food Technology, 141-144 (1994).
26) Meier W. et al. : Mitt. Geb. Lebensm. Hyg., 87, 118-122 (1996).
27) Ndiaye B. et al. : Radiat. Phys. Chem., 55 (4), 437-445 (1999).
28) Tanabe H. et al. : Radioisotopes, 51, 109-119 (2002).
29) 田邊寛子他 : Radioisotopes, 51, 157-166 (2002).
30) Ndiaye B. et al. : J. Chromatogr. A., 858 (1), 109-115 (1999).
31) Marchioni E. et al. : Radiat. Phys. Chem., 63 (3-6), 447-450 (2002).
32) Lembke P. et al : J. Agr. Food Chem., 43 (1), 8-45 (1995).
33) Pfordt J. and Vongrabowski H. U. : Z. Lebensm. Unters. For. 200 (3), 198-202 (1995).
34) Rahman R., et al : Nahrung, 40 (2), 55-59 (1996).
35) Stewart E. M. et al. : J. Sci. Food Agr., 80 (1), 121-130 (2000).
36) Horvatovich P. et al. : J. Chromatogr. A., 968 (1-2), 251-255 (2002).
37) Lee H. J. et al. : J. Food Protect., 63 (11), 1563-1569 (2000).
38) 田邊寛子, 後藤典子 : 食品照射, 37, 17-23 (2002).
39) Thayer D. W. et al. : J. Food Prot., 50 (4), 278-288 (1987).
40) Delincée H. and Pool-Zobel B. L. : Radiat. Phys. Chem., 52, 39-42 (1998).
41) Delincée H. et al. : Genotoxizität von 2-Dodecyl-cyclobutanon, In '5 Deutsche Tagung Lebensmittelbestrahlung' (Knörr M. et al. eds.), Karlsruhe, 11-12 November (1998), Berichte der Bundesforschungsanstalt für Ernährung, Karlsruhe, BFE-R--99-01, p.262-269 (1999).
42) Burnouf D. et al. : Etude toxicologique transfrontalière destinée à évaluer le risque encouru lors de la consommation d'aliments gras ionisés - Toxikologische Untersuchung zur Risikoberwertung beim Verzehr von bestrahlten fetthaltigen Lebensmitteln - Eine französisch-deutsche Studie im Grenzraum Oberrhein, Rapport final d'étude Interreg II, projet No 3171, p.234 (2001)
レポートのフルテキストはドイツ国立栄養生理研究所の HP から閲覧できる http://www.bfa-ernaehrung.de/Bfe-Deutsch/Information/e-docs/bfer0202.pdf
また summary は下記 HP から閲覧できる。
"Information about the potential toxicity of 2-alkylcyclobutanones, a group of substances exclusively formed upon irradiation of food containing fat" (2002) www.iaea.org/programmes/rifa/icgfi/documents/summary-press.pdf
43) ICGFI : Peer Review on the Dr. H. Delincée's Report on the genotoxicity of 2-Alkylcyclobutanone, 16th Annual Meeting of ICGFI Agenda Item 4 Room Doc No 4.
44) Marchioni E. and Burnouf D. : 2-Alkylcyclobutanones - toxicological effects, oral presentation presented during the Joint Working Group on Genetically Modified, Novel Foods du Scientific Committee on Food, Bruxelles Belgium, 01 Februar (2002).
45) Horvatovich, P. : Formation des 2-alkylcyclobutanones à partir des triglycérides dans les aliments traités par ionization, Doctorat de l'Université Louis Pasteur de Strasbourg (2001).
46) Delincée H. et al. : Radiat. Phys. Chem., 63, 431-435 (2002).
47) Delincée H. et al. : Genotoxicity of 2-alkylcyclobutanones, markers for an irradiation treatment in fat-containing food, Poster presented during the XII International Meeting on Radiation Processing, Avignon France, 26-30 March (2001). (Abstract published in Conference Program and Abstracts, IMRP-107, II-A4, p. 148-149, 2001.)
48) Delincée H. et al. : Genotoxicity of 2-alkylcyclobutanones, markers for an irradiation treatment in fat-containing food II, Cyto- and genotoxic potential of 2-tetradecenyl-cyclobutanone, Poster presented during the European Environmental Mutagen Society (EEMS) GUM Meeting, Karlsruhe Germany, 25-28 September (2001). (Abstract published in Conference Program and Abstracts, p. 73, 2001.)
49) Delincée H. et al. : Cyto- und Genotoxizität von 2-Alkylcyclobutanonen, Poster presented during the 39, Meeting of the German Nutrition Society, Jena Germany, 14-15 March (2002). (Abstract published in Proc. Germ. Nutr. Soc., 4, 31-32, 2002.)
50) Pelzer A. et al. : Induction of oxidative DNA damage by cyclobutanones generated by irradiation of fat-containing food, Poster presented during the European Environmental Mutagen Society (EEMS) GUM Meeting, Karlsruhe Germany, 25-28 September (2001). Abstract published in Conference Program and Abstracts, p. 74, 2001.
51) Raul F. et al. : Nutr. Cancer., 44 (2), 88-191 (2002).
52) Horvatovich P. et al. : J. Food Prot., 65(10), 1610-1613 (2002).
53) The European Comittiee : State ment of the Scientific Committee on Food on a Report on 2-alkylcyclobutanone http://europa.eu.int/comm/food/fs/sc/scf/index_en.html
54) WHO : WHO Statement on 2-Dodecylcyclobutanone and Related Compounds. March 2003 (19th ICGFI 総会参加メンバーに配信)
(2003 年 8 月 30 日受理)
|
|