表 1. 遺伝毒性試験の種類と試験材料
 |
3. 照射と試験条件など
(1) タマネギ
(2) コメ
(3) コムギ
(4) ウインナーソーセージおよびかまぼこ
(5) ミカン
(6) ジャガイモ
(7) 照射コムギ粉による倍数性細胞誘発
(8) 照射スパイスの変異原性
4. 実験結果と考察
(1) タマネギ
(2) コメ
(3) コムギ
(4) ウインナーソーセージおよびかまぼこ
(5) ミカン
(6) ジャガイモ
(7) 照射コムギ粉による倍数性細胞誘発
(8) 照射スパイスの変異原性
わが国で照射食品の健全性 / 安全性などの総合的な研究が開始されたのは、1967 年に一連の研究が原子力特定総合研究に指定されてからである。この研究班では、殺菌、殺虫、発芽防止などの目的で放射線照射された食品に関して、国立試験研究機関 (当時の栄養研究所、予防衛生研究所、衛生試験所) が中心となり、栄養成分の変化、慢性毒性試験、世代試験などの試験がスタートした。その後、発がんや次世代での遺伝的障害の予知にかかわる遺伝毒性の重要性が一般に認識され始めるようになったのは 1970 年代に入ってからである。秦野研究所では、1977 年より照射食品に関して細菌、培養細胞、動物個体を用いた総合的な遺伝毒性試験を開始した1)。その中には、現在では多数の動物を用いることから動物愛護の観点より実施が難しい次世代 (生殖細胞への影響) への遺伝毒性を調べる優性致死試験といった大規模な試験も含まれている。照射食品による遺伝学的影響に関して、このような多種の試験系を用いたバイオアッセイによる総合的な研究は国際的にも例を見ないことから、いくつかの研究班報告書をまとめここに紹介する。
ここで試験された食品そのものは、通常我々が食している農産物および食肉加工食品であり、長い食経験から食品としては経験的に安全性が確認されているものである。遺伝的安全性を調べるには、対照として用いる非照射食品の毒性反応との比較になるが、非照射の食品そのものにおいても動物を用いた毒性試験の実施は、投与量、食品の形態、投与経路、栄養的なバランスなどで様々な困難が伴う。遺伝毒性試験では、放射線照射に伴って生じるかもしれない食品中の放射線分解生成物による遺伝的な有害性の可能性について検討する事になる。
遺伝毒性とは、工業原料、医薬、農薬、環境汚染物質などの化学物質や、放射線、紫外線など物理化学的な要因により DNA などに傷害を与え遺伝形質を変化させる事象で、DNA 損傷、突然変異、染色体異常までを包含する (注 : 変異原性 (Mutagenicity) の用語が一般に用いられてきたが、近年、国際的にまた行政のガイドラインにおいても広義の意味で遺伝毒性 (Genotoxicity) が使われている)。標的は主として DNA であるが、DNA に限らずタンパクなどが修飾される事により、結果として染色体の切断や再結合、数的異常などを生じる場合もある。このような DNA や染色体の傷害は、体細胞ではがんの誘発要因となり、生殖細胞で生じそれが受精にあずかると胚死亡や流産、奇形、そして転座や遺伝子異常を有する個体を出産する可能性がある。
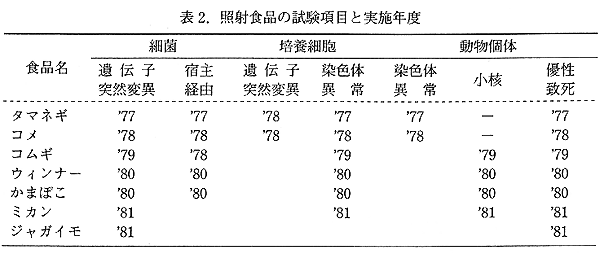
遺伝毒性の検出はそのエンドポイントにより試験系は様々である。表 1 に試験の種類と細胞などの材料を示した。1977 年から 1981 年にかけて原子力特定総合研究で試験された食品は、タマネギ、コメ、コムギ、ウインナーソーセージ、かまぼこ、ミカン、ジャガイモの 7 品目で、表 2 に試験項目と実施年度を示した。
通常、細菌や細胞を用いる遺伝子突然変異試験としては、細菌を用いる復帰変異試験や V79 細胞やマウスリンフォーマ細胞を用いる薬剤抵抗性をマーカーとする試験があるが、照射食品では細菌を用いる復帰変異試験と V79 細胞を用いる試験が実施された。生体内で代謝され変異原性を示す物質の検出に関しては、最近は薬物誘導をかけたラット肝臓から得られた肝ホモジネートを用いる代謝活性化試験が実施されているが、当時は宿主経由法も行われた。この試験は検体をマウスに投与し、その後腹腔内に試験菌株を短時間注入して回収し、その突然変異を調べる方法である。培養細胞を用いる試験としては、V79 細胞を用いる遺伝子突然変異試験、チャイニーズ・ハムスター細胞やヒトリンパ球を用いる染色体異常試験が行われた。動物個体を用いる試験としては、マウスおよびチャイニーズ・ハムスターなどの動物を用いて染色体異常試験、小核試験、優性致死試験などが実施された。優性致死試験では、各群 30 頭の雄マウスを用い、毎週 1 頭の雄に対し 2 頭の雌マウスと交配しこれを 8 週間続けると、計算上 480 頭の妊娠雌マウスが得られる。1 試験で 1 非照射群、2 照射群、1 溶媒対照群、1 陽性対照群の全 5 群構成であることから、(30 + 480)×5 群で 2550 頭のマウスを用いたことになる。本研究では、上記の試験条件で実施するフル優性致死試験と、検体を長期処理し交配を 1 週間のみ実施する簡便法の二つの方法で実施した (表 3)。
タマネギ、ミカン、ジャガイモ、コムギ粉の優性致死試験では 8 週間連続交配のフルテストを実施した。8 週間もの長期にわたって交配する理由は、マウスの場合、精子の幹細胞 (stem cell) である精祖細胞から精子になるまでの精子形成過程 (spermatogenesis) はおよそ 6 週間かかることから、照射食品の影響を精子分化の全過程と幹細胞となる精祖細胞の増殖期にも作用させて調べる為に長期にわたって交配した。マウスは秦野研究所で常に使用し、背景データのある BDF1 マウス (C57BL と DBA の近交系間交配 F1 マウス) を用いた。
原子力特定総合研究が終了した後、1986 年から 1991 年にかけて、日本アイソトープ協会・食品照射委員会では、当時国際的に論点となっていた幾つかの研究に関して試験を行った。インドで報告2, 3) された倍数性細胞の誘発を確認するため、ガンマ線照射した小麦粉をチャイニーズ・ハムスターとラットに給餌し骨髄細胞での倍数性細胞誘発と末梢血赤血球での小核誘発をみる試験を実施した。また、細菌などの汚染が多いスパイスに関しては、ガンマ線照射によるスパイスの突然変異誘発を細菌を用いる復帰変異試験を用いて検討した。
 |
 |
 |
試験した食品の照射目的と照射時の試料の状態、照射線量などの試験条件を表4に示した。線源はミカンの電子線照射を除き、すべてコバルト 60 によるγ線照射によった。
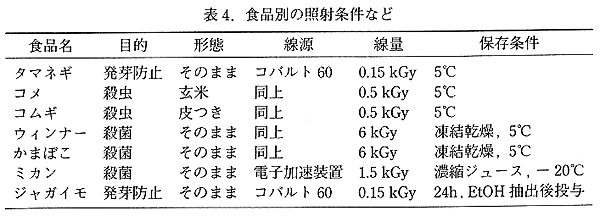 |
タマネギは発芽防止の目的であるが、実用上限の線量である 0.15kGy で照射後、5 ヶ月間、5℃ の冷暗所で貯蔵したものを用いた。
細菌を用いる復帰変異試験及び宿主経由試験では TA1535、TA100、TA1537、TA98 の菌株を用いた。照射タマネギの試料はタマネギをミキサーでジュースにしてろ過した後、減圧濃縮し、-20℃ 下で凍結保存した。in vitro 染色体異常試験では同様にして作製した凍結乾燥粉末を用いた。in vivo の試験においても、試料を家庭用のジューサー、さらにホモブレンダーで粉砕し、このホモジネートを凍結乾燥して試料とした。
9 週齢 BDF1 雄マウスを用いる染色体異常試験と優性致死試験では、投与は凍結乾燥試料に蒸留水を加えて混和し、照射タマネギ投与群では 1 日あたり 2 g/kg (染色体異常試験のみ)、4 g/kg、および 8 g/kg、非照射タマネギ投与群では 8 g/kg、陰性対照では蒸留水を、5 日間、胃ゾンデを用いて連続投与した。陽性対照は MMS (メチルメタンスルフォネート)、100 mg/kg を 1 回腹腔投与した。染色体異常試験では各群 5 頭の雄マウスを用い、最終投与の 20 時間後に骨髄細胞の染色体標本を作成した。優性致死試験では各群 15 - 19 頭の雄マウスを用い、最終投与後 8 週にわたり、毎週 1 頭の雄マウスあたり 2 頭の雌マウスと交配した。交尾確認後、雌マウスは妊娠 13 日に解剖するまで別ケージで飼育した。妊娠 13 日目に解剖して黄体数 (排卵数の推定) や着床数、生存胚、死胚などを調べた。
コメの照射は殺虫の目的である。玄米を実用上限の線量である 0.5 kGy 照射した。細菌を用いる復帰変異試験では TA100 および TA98 の菌株を用いた。これらの菌株ではヒスチジン要求性から非要求性への復帰変異を指標として調べるため、ヒスチジンを含有する試料での試験は問題があることから、試験に用いた 80% メタノール抽出液の減圧濃縮物についてアミノ酸分析をした。その結果 100g の玄米あたりのアミノ酸の全量は 4.275g、そのうちヒスチジンは 0.06mg と非常に少ない量であったことからその影響はないと判断した。
宿主経由試験では、1 群 5 頭のマウスを用い、1 日 1 回、上記の試料 0.5mL を 3 日間連続経口投与した。3 回目の投与と同時に検定菌液 1mL を腹腔内に投与し、3時間後に頚椎脱臼後、生理食塩水 1mL を腹腔内に投与して腹腔内の検定菌液を回収して突然変異を調べた。V79 細胞を用いる突然変異試験では、100% または 80% のメタノール、または水で抽出したものを減圧濃縮して試料原液とした。これらの試料を細胞に 16 時間作用させ、144 時間の発現時間で突然変異の誘発を調べた。 in vitro 染色体異常試験では CHL/IU 細胞を用いた。80% メタノールを用いて抽出した玄米エキスを種々の濃度で、24 及び 48 時間処理して標本作製した。チャイニーズ・ハムスターを用いる急性の in vivo 染色体異常試験では、1 群 5 頭 (8 週齢、平均体重 33g、雄) の動物を用い、照射米の高用量投与群ではコメ粉末 1g を水 1.5 ml、低用量群では 1g を水 3ml に懸濁し動物体重 (g) あたり 0.05 mL を胃ゾンデを用いて経口的に 1 回投与した。一方、混餌投与の試験では、照射米を 40% 含有する固形餌料を 5 日間自由に摂食させた。
マウスを用いる優性致死試験では、1 群 30 頭の雄マウスを用い、照射米 40% 含有固形餌料を 6 週齢から 14 週齢までの 8 週にわたり摂食させた。交配は、投与後 1 週間の感受性の高い時期に、1 頭の雄に対して 2 頭の雌マウスと交配した。
米国産 (Dark Northern Spring) のコムギに、実用上限の線量である 0.5 kGy を照射し試料を作製した。細菌を用いる突然変異誘発試験ではコムギを 70% メタノールに 100mg/mL の割合に浮遊させ、室温に4時間放置後試験に用いた。染色体異常試験と宿主経由試験では、コムギ 2kg を 6L の 70% のメタノールで抽出し、減圧濃縮後、凍結乾燥したものを用いた (照射コムギ 1kg 当りの凍結乾燥物重量は 58.2g である)。
動物を用いる染色体異常試験では、マウスを用いる小核試験を代替試験として実施した。試料は照射コムギ抽出物を 0.5% CMC-Na 液に懸濁し、マウス体重あたりそれぞれ 72.5、145、290mg/kg を 1 日 1 回、5 日間にわたって経口投与した。非照射コムギは 283mg/kg、陽性対照は MTX (メソトレキセート)、2.5mg/kg をそれぞれ 5 日間連投した。優性致死試験では、コメの場合と同様に混餌により 8 週間摂食させ、簡便法により投与後 1 週間交配した。
ウインナーソーセージおよびかまぼこはそのままの状態で実用線量上限の約 2 倍にあたる 6kGy 照射し、凍結乾燥したものを全ての試験に用いた。in vitro 染色体異常試験では凍結乾燥物のメタノール抽出物をヒトリンパ球およびチャイニーズ・ハムスター細胞に処理した。in vivo でのマウス骨髄細胞の小核試験と優性致死試験では、凍結乾燥物を用いて簡便法により試験した。
ミカンは 1.5kGy で電子線滅菌し、濃縮ジュース (5 倍) の状態で -20℃ に保存し試験に用いた。細菌を用いる試験では、濃縮ジュースを平板当り、0.5mL および 1.0mL 添加して試験に用いた。マウス小核試験では、各群 5 頭のマウスに濃縮ジュースを 1 日 2 回、5 日間経口投与し、最終投与の 20 時間後に小核標本を作製した。優性致死試験では 1 群 30 匹の雄マウスに濃縮ジュースを 1 日 2 回、5 日間経口投与し、その後 4 日に 1 回、8 週間にわたり 1 頭の雌マウスと交配した。
ジャガイモはエタノール抽出物を用いて各試験を実施した。ジャガイモは、わが国において発芽防止の目的で 0.15kGy 以下のγ線照射が許可された唯一の食品である。1972 年、Kuzin ら4) により照射ジャガイモのエタノール抽出物がマウスにおいて優性致死を誘発するとの報告がなされた事から、照射条件等はその論文に合わせ、照射 24 時間後エタノール抽出し、抽出物を 1 日 2 回、7 日間経口投与した。その後、4 日に 1 回、それぞれ 1 頭の雌マウスと交配し、投与後 8 週間にわたり交配を続けた。各群 30 頭の雄マウスを用いた。
照射コムギ粉を動物に長期間与えると倍数性細胞を誘発するという Renner5) の報告、また栄養失調の子供に照射コムギを与えると倍数性細胞が高くなるという Bhaskaram らの報告6) があることから、照射コムギ粉を照射直後に給餌した場合と、長期間給餌した場合の細胞遺伝的影響について、チャイニーズ・ハムスターとラットを用いて調べた。
チャイニーズ・ハムスターを用いる実験では、照射コムギ粉の照射条件は Renner の照射滅菌飼料の条件に近い、7.5kGy、15kGy、30kGy を照射した。照射時のラジカル産生による影響を見るためを、脱気して窒素ガスに置換した群と置換しない群を設けた。ハムスターへの給餌は、各群 6 頭のハムスターに、照射 8 時間後に粉末飼料として 8 - 72 時間以内に与えた。給餌開始 72 時間後に標本作製し骨髄細胞の倍数性細胞の分析に用いた。また、48 時間後および 72 時間後の末梢血を尾部から採血し、林らの方法7) により末梢赤血球の小核標本を作製した。染色はアクリジンオレンジ染色によった。
ラットを用いる実験では、コムギ粉の照射は Vijayalaxmi ら2) の線量にあわせ、0.75kGy とした。照射コムギは照射 2 日後に粉末飼料として、各群 9 頭のラットに 6 週間および 12 週間給餌し、その後骨髄細胞から染色体標本を作製した。末梢血からは小核標本を作製した。
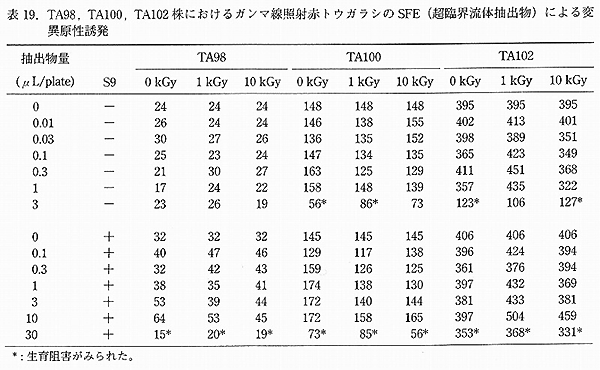
試験は、TA100、TA98 および TA102 の 3 菌株を用いる復帰変異試験を実施した。スパイスは黒コショウ、赤トウガラシ、ナツメグ、パプリカを用いた。照射線量は 1kGy と 10kGy で照射し、超臨界流体抽出により抽出物を作成した。黒コショウについては、50% 抽出物も併せて作製した。
原子力特定総合研究で実施した 7 品目の照射食品についての遺伝毒性試験結果を表 5 に示した。試験した全ての照射食品において、どの試験系においても全て陰性の結果が得られた。それぞれのデータについて述べる。
 |
細菌を用いる復帰変異試験では、試験に用いた 4 菌株全てにおいて、照射、非照射ともに、また代謝活性化の有無に限らず、変異コロニーの増加は見られなかった。また、宿主経由試験においても、同様に全ての用量において対照群との差は見られず、細菌を用いる系では照射タマネギの変異原性は認められないと判断した。
培養細胞を用いる染色体異常試験では、ヒト胎児由来細胞 (HE2144) とチャイニーズ・ハムスター由来 (Don-6) 細胞を用いて、染色体異常と SCE 及び小核の誘発が調べられた。その結果、照射タマネギエキスの凍結粉末は、ヒト細胞に対して照射および非照射群ともに 2mg/ml で著しい分裂抑制が見られた。ハムスター細胞では、照射群では 4mg/ml、非照射群では 2mg/ml で同様の分裂抑制が見られた。染色体切断に関しては、チャイニーズ・ハムスターでは染色体切断の増加が見られたが、照射群よりむしろ非照射群でやや高く異常が誘発された。ヒト細胞では殆んど影響がなかった。小核の誘発に関しても同様な傾向が見られたが、照射による差はみられなかった。SCE の誘発に関しては、照射、非照射ともに SCE が誘発されたが、照射による差は見られなかった。
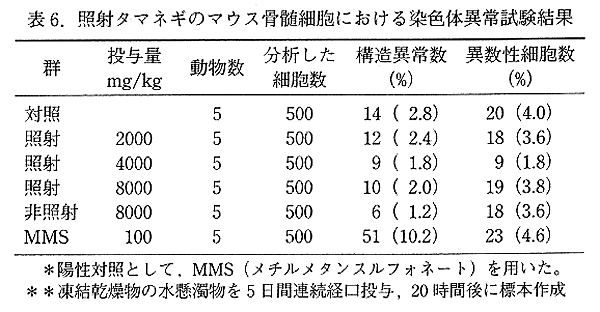
マウス (BDF1) を用いた in vivo 染色体異常試験の結果を表 6 に示した。タマネギの凍結乾燥粉末に水に懸濁した照射検体投与のいずれの群においても、対照群と比べて染色体異常の有意な増加は見られなかった。特に、8000mg/kg を 5 日間連続経口投与 (体重 50kg のヒトが生タマネギ 4kg を 5 日間毎日食べる量に相当) するという過酷な条件においても、照射による影響はみられなかった。一方、ラット (Long-Evans 系) の骨髄細胞を用いた染色体異常試験では、経口投与と腹腔内投与の試験をおこなったが、いずれの試験でも照射群と非照射群で有意な異常誘発は見られなかった。優性致死試験の結果を図 1 に示したが、照射および非照射ともに、黄体数、着床数、生存胚数、死胚数などに、有意な変化はみられず、照射による優性致死の誘発は認められなかった。
 |
 |
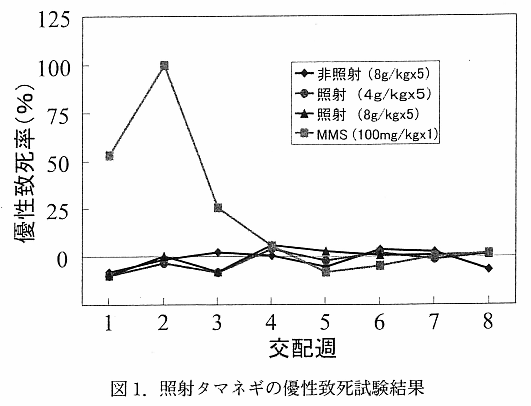 |
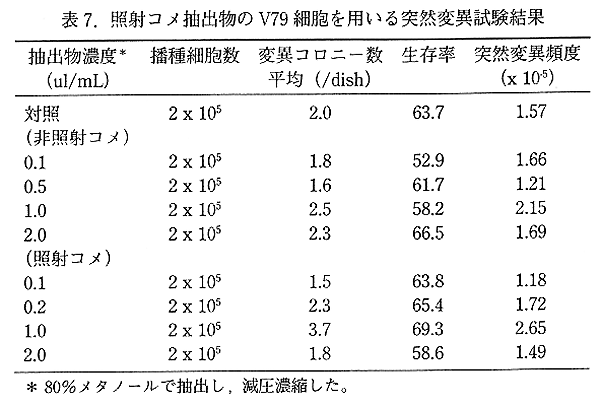
細菌を用いる復帰変異試験では、TA100、TA98の両菌株共に照射・非照射を問わず変異コロニーの増加は見られなかった。また、宿主経由試験でも照射・非照射において変異誘発は認められなかった。V79 細胞を用いる突然変異誘発試験では、100%、80%、水の 3 種の玄米抽出物について照射、非照射および代謝活性化の有無にかかわらず突然変異の有意な増加は認められなかった (表 7)。チャイニーズ・ハムスターの CHL/IU 細胞を用いる染色体異常試験では、照射・非照射の 24 時間および 48 時間処理の何れの条件においても、染色体異常の誘発は認められなかった。
チャイニーズ・ハムスターにコメ粉末を胃ゾンデを用いて経口的に 1 回投与した in vivo 染色体異常試験では、高用量、中用量群共に照射および非照射米での有意な染色体異常の増加は見られなかった。一方、照射米 40% 含有の固形餌料を 5 日間自由に摂食させた混餌投与群においても、有意な染色体異常誘発は認められなかった。マウスを用いる優性致死試験では、照射米 40% 含有固形餌料を 6 週齢から 14 週齢までの 8 週にわたり摂食させ、投与後 1 週間に 1 頭の雄に対して 2 頭の雌マウスと交配した結果、照射および非照射群ともに黄体数、着床数、生存胚数、死胚数などに対照群と差がみられず、照射による優性致死の誘発は認められなかった (表 8)。
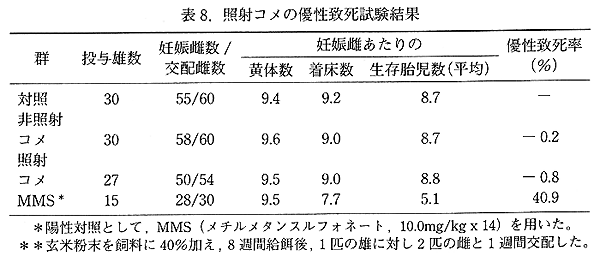 |
細菌を用いる突然変異試験では、試験に用いた 6 菌株全てにおいて、照射・非照射を問わず突然変異の誘発はみられなかった。マウス宿主経由試験では、1 群 6 頭のマウスに 1% CMC-Na 水溶液にコムギエキスを懸濁して、3 日間経口投与したが、腹腔内より回収した検定菌液において照射・非照射ともに変異コロニーの誘発は認められなかった。培養細胞 (CHL/IU) を用いる染色体異常試験では、コムギ抽出物を 0.8mg/mL、1.0mg/mL、1.5mg/mL の 3 濃度を 24 時間および 48 時間処理したが、照射・非照射群ともに染色体異常の有意な誘発は認められなかった。マウスを用いる小核試験ではコムギ抽出物を 72.5mg/kg、145mg/kg、290mg/kg 、5 日間経口投与し、骨髄細胞の小核を観察した。マウスへの投与量 290mg/kg は、体重 50kg のヒトの場合、コムギ 250g に相当する量である。小核を有する多染性赤血球の出現頻度は照射、非照射ともに有意な上昇は認められなかった (表 9)。照射コムギを 40% 含む固形飼料を 8 週間与えた照射・非照射群においても有意な優性致死誘発率は認められなかった (表 10)。Bhaskaram ら6) は、栄養失調の子供達に照射コムギを与えた実験では、リンパ球の倍数性細胞が 6 週目にピークになり、その原因として、貯蔵すると分解するようなコルヒチン様の物質がガンマ線照射により生成される可能性をあげている。仮にその考えが正しいと仮定すると、小核試験や優性致死試験においても何らかの作用が見られても良いと考えるが、何れの試験も陰性の結果となった。
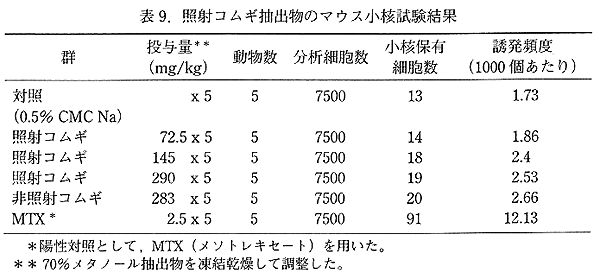 |
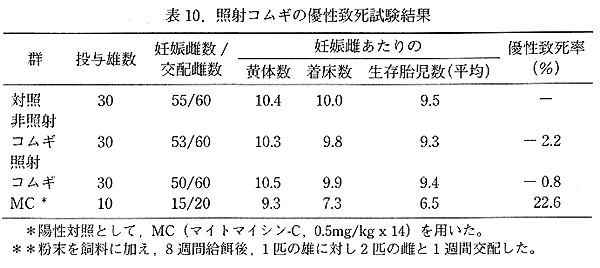 |
ウインナーソーセージおよびかまぼこは実用線量上限の約 2 倍にあたる 6kGy 照射し、メタノール抽出物の凍結乾燥物を得た。細菌を用いる突然変異試験、マウスによる宿主経由試験、ヒトリンパ球およびチャイニーズ・ハムスター細胞を用いる in vitro 染色体異常試験では何れも陰性の結果が得られた。また、動物を用いたマウス骨髄細胞の小核試験においても陰性となった。ウインナーソーセージおよびかまぼこの凍結乾燥物をそれぞれ飼料に加えて 8 週間給餌した優性致死試験においては、両試験ともに、照射による優性致死の作用は認められなかった (表 11、12)。
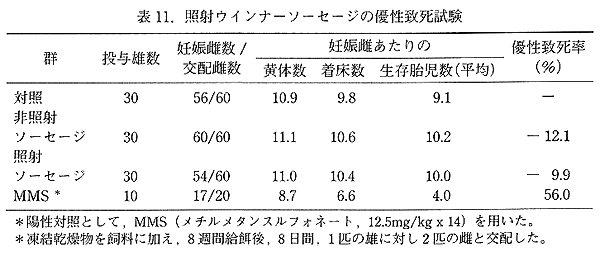 |
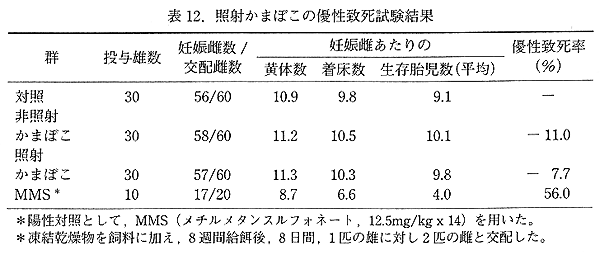 |
細菌を用いる復帰変異試験では 6 菌株を用いたが、S9 (-)、S9 (+) のいずれの条件下においても変異の誘発は認められなかった。ただし、TA100 においては照射の有無にかかわらず突然変異率がやや増加 (約 2 倍程度) したが、これはミカンに含まれるある種の成分により変異が誘発されるることが知られていることから、照射に起因するものではないと判断した。染色体異常試験においても陰性となった。マウス小核試験、優性致死試験では、ミカン濃縮ジュース (5 倍) を 1 日 2 回、5 日間経口投与したが、何れの試験においても照射・非照射群ともに有意な誘発は見られなかった (図 2)。
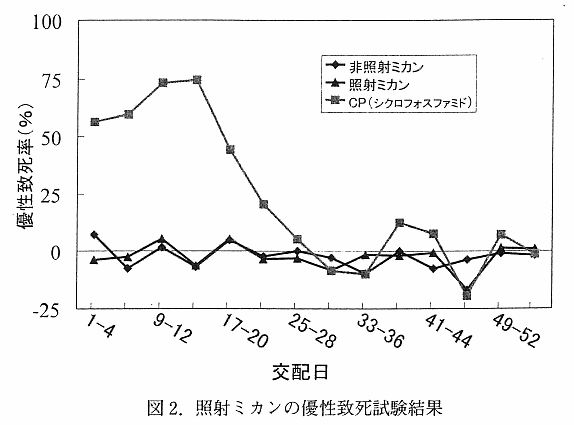 |
実施した全ての試験で陰性の結果が得られた。照射食品の中で陽性の結果が報告されている優性致死試験では、照射ジャガイモのエタノール抽出物で照射・非照射両群共に、精子形成過程の全過程において陽性の結果を示すような傾向は見られなかった (図 3)。Kuzin ら4) は、照射ジャガイモのエタノール抽出物がマウスに対して優性致死を誘発すると報告した。これが照射食品で遺伝学的な危険性を指摘した唯一の報告である。照射により毒物 (ラジオトキシン) ができるためと説明されたが、1 群あたりの雄マウスも 5 頭と少なく (通常は、15 〜 30 頭)、また、マウスの系統も定かでない事から、試験の再現性に問題があった事が考えられる。その後彼らは、加熱貯蔵中にラジオトキシンは消滅する事を報告した。また、分析化学的な方法でも検出できなかった。その後、IFTA (International Project in the Field of Food Irradiation, Karlsruhe, Germany) がカナダの Bio-Research Laboratories Ltd. に依頼して行った試験8) でも陰性の結果が得られているが、その試験においても 1 群 5 頭の雄マウスしか用いてなく、投与後の交配期間は 5 週間と十分な条件ではなかった。一方、本研究で実施した優性致死試験では、動物は常に安定した結果の得られる BDF1 マウス (C57BL と DBA の近交系間交配 F1 マウス) を用い、1 群 30 頭の雄に対し、4 日に 1 回、連続 8 週間の交配を行っており、実験の信頼度も極めて高いと考える。以上の結果より、先に報告された陽性の報告に関する再現性は得られず、照射ジャガイモに関しては遺伝毒性の可能性はないと結論した。
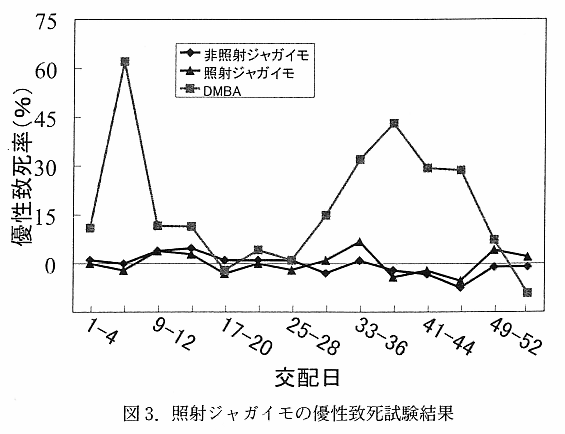 |
照射コムギ粉の給餌開始 48 時間および 72 時間後の末梢血中の小核分析では何れの照射群においても小核の有意な増加はみられなかった。活性酸素の生成を抑制する目的で空気を窒素ガスに置換した群と置換しない群それぞれにおいて、非照射群との間で検定の繰り返しによる多重性を考慮して Fischer の確率計算法により検定を行った結果、どの処理群においても倍数性細胞の有意な増加や、線量依存的な倍数性細胞の誘発は見られなかった9) (表 13、14)。
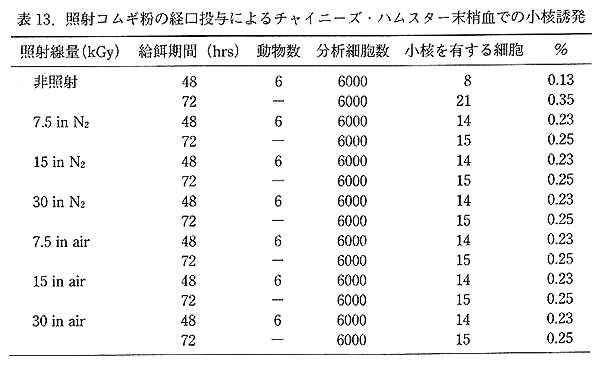 |
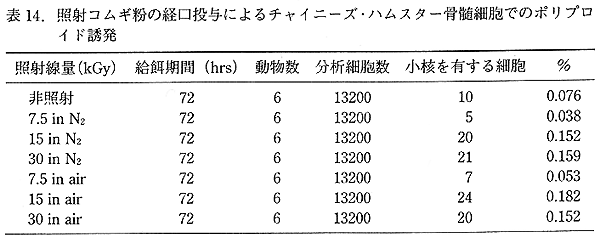 |
照射コムギ粉の給餌開始 6 週と 12 週後の末梢血中の小核については、何れの条件においても有意な増加は見られなかった。また、12 週後のラット骨髄細胞における倍数性細胞についても非照射群との間に有意な増加は見られなかった。
本実験では動物飼料の殺菌線量レベルである 30kGy を含み、7.5kGy、15kGy、30kGy の線量で照射したコムギ粉を、照射 8 時間後に飼料に加えて 3 日間ハムスターに給餌した。しかしながら、骨髄細胞において明らかな倍数性細胞の誘発は見られなかった (表 15、16)。また、本実験と同様に Tesh ら (1977) も、倍数性細胞と小核誘発に関して照射による影響はないことを報告10) している。Renner5) は、照射後 3 日以内に照射飼料を与えた場合、非照射群に比べて倍数性細胞が増加し、照射 6 週間保存した後に飼料を与えた場合にはその影響がないことを報告している。このことは、照射によってラジカルが生成され、倍数性細胞を誘発するような成分の変化をきたしている可能性が示唆された。そこで本実験では、ガンマ線照射による H2O2 その他の活性酸素種の生成を抑える目的で、照射時のコムギ粉中の空気を窒素に置換した群と置換しない群を設けて実験を行った。しかしながら、何れの条件下においても倍数性細胞の生成に顕著な差は見られず、倍数性細胞に影響を及ぼすような変化はみられなかった。
Vijayalaxmi ら2) は、0.75kGy の放射線を照射したコムギを含む飼料をマウス、ラット、サルなどに長期間与えると倍数性細胞を誘発するという報告をしている。そこで本実験では、ラットに 12 週間給餌し、骨髄細胞の倍数性細胞誘発と、末梢赤血球中の小核誘発を調べた。その結果、12 週後のラット骨髄でも倍数性細胞の誘発は見られず、6 週後と 12 週後に調べた末梢赤血球の小核についても有意な増加は認められなかった (表 16)。
 |
 |
以上の結果より、前述の原子力特定総合研究で実施した照射コムギの遺伝毒性試験結果がすべて陰性である事も考慮し、国外で報告されている初期の陽性結果2), 3), 5), 6) については再現性が得られず、照射コムギ粉による遺伝毒性作用はないものと考える。
黒コショウでは、エタノール抽出物と超臨界流体抽出による抽出法の違いによる変異原性の比較をしたところ、いずれの抽出物でも TA98 においてのみ代謝活性化法で照射、非照射ともに弱い変異コロニー数の増加が認められたが、照射によって増加することはなく (表 17)、また抽出法による差も認められなかった。赤トウガラシでは、非照射の TA98 の代謝活性化法において、対照の 2 倍程度の変異コロニー数増加が認められたが、照射群については変異コロニーの増加は認められなかった (表 18、19)。ナツメグ、パプリカについては、照射、非照射のいずれの抽出物も全ての用量で変異コロニーの増加は認められなかった。黒コショウと赤トウガラシの弱い変異コロニー誘発については、コショウはコウジカビが産生するアフラトキシンで汚染される事があることから、今回の抽出物に関して、アフラトキシンの存在を薄層クロマトグラフィーにより確認したがその存在を示すことはできなかった。このことから、弱い変異コロニーの誘発はコショウ成分中の物質によるものと考えられた11)。
スパイスは亜熱帯で生産される為、微生物や真菌、及び真菌の代謝産物であるマイコトキシンによる汚染を受けやすく、食品衛生上何らかの方法により殺菌する必要がある。これまでその微生物汚染を軽減する為、臭化メチル、EO ガスや短時間の高温殺菌が行われてきた。しかし、臭化メチルは毒性が強く、オゾン層破壊物質で 2005 年には撤廃される予定であり、一方、EO ガスは強い遺伝毒性物質であることから適切とはいえない。香辛料としての特性を失うことなく殺菌する方法として、放射線照射による殺菌が最も有効とされ、照射食品の中でもスパイスの照射が多くの国々で採用されている。したがって、食物の大部分を海外からの輸入に頼っているわが国では、我々の知らないうちに食している可能性も否定できないことから、検知法による識別も重要となる。スパイスは種類も多く、そのものの生理作用については多くの報告がある一方で、照射スパイスの安全性に関する報告は少ない。本研究では細菌を用いる復帰変異試験のデータを示したが、培養細胞や動物を用いた遺伝毒性試験は未だ行われておらず、リスク評価の観点から、各種の試験系のデータが必要とされる食品である。
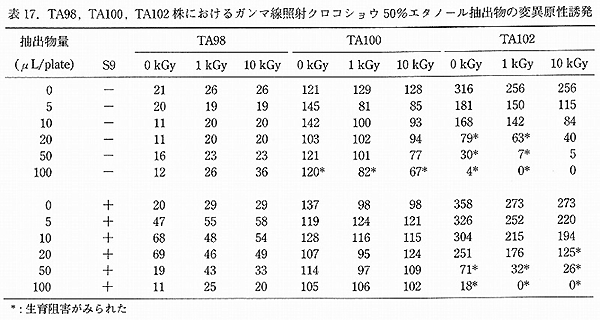 |
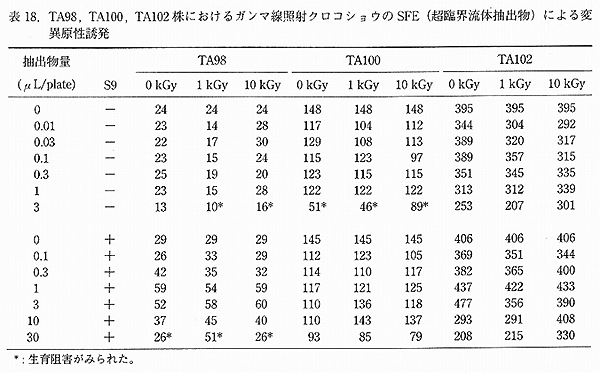 |
 |
本項では、秦野研究所で実施した照射食品の遺伝毒性に関するデータをまとめ、網羅的に概説した。投与量としてはかなり過酷な試験条件にもかかわらず、試験した照射食品の全てに陰性の結果が得られ、問題となるような点はみられなかったことから、本試験条件下では、照射食品の遺伝毒性はないものと考える。
我々が普段から食している自然食品や天然添加物においても遺伝毒性を示す食品は数多くある。魚や肉の焼け焦げで知られるごとく加熱調理することで強烈な発がん物質が生成されることも分かってきたが、その後の研究により同時に野菜類を食べることで遺伝毒性作用が軽減・消失する事や、我々自身がその部分を食べない事でその毒作用を回避するようになってきた。食品照射は食品保存や食品衛生の面から極めて効果的であり、用いられる実用的な照射線量では、食感が損なわれず栄養成分の変化も少ないなどのメリットがあることから、多くの国で食品に照射されている。一方高線量では、グルコースのように特定の栄養成分の変化によって変異原性物質が生じ、それはまた果実中の成分で不活化される例も知られている12-16)。このように、照射によって起こりうる可能性のある未知の成分変化や生成物に対する生物作用に関しては、バイオアッセイによって照射線量の毒性学的な安全域を確認し、消費者が安心して食べられるような科学的なデータを提供する事が重要である。
照射食品の健全性 / 安全性評価について早くからその重要性を唱えられ、本研究にご助言下さった松山晃博士に深く感謝申し上げます。なお本稿は、秦野研究所遺伝毒性部門の礎を作られこの研究の指揮をとられた (故) 岩原繁雄博士と、現在は数名のメンバーしか秦野研究所に在籍していないが、当時先輩同僚として一緒に研究を行った、渋谷徹博士、高鳥浩介博士、室田哲郎博士、加藤基恵博士、山影康次博士、坂本 (荒川) 京子、金指 (川上) 久美子の各氏にささげたい。
1) 岩原繁雄 : 秦野研究所で実施された照射食品の遺伝毒性試験, 秦野研究所年報, 6, 77-88 (1983).
2) Vijayalaxmi and G. Sadasivan : Int. J. Radiat. Biol., 27, 135-142 (1975).
3) Vijayalaxmi and S. G. Srikantia : India. Radiat. Phys. Chem., 34, 941-952 (1989).
4) V. A. Kopylov et al. : Radiobilogia, 12, 524 (1972).
5) H. W. Renner : Toxicology, 8, 213-222 (1977).
6) C. Bhaskaram and G. Sadasivan : Am. J. Clin. Nutr., 28, 130-135 (1975).
7) 林 真 : 「小核試験」−実験法からデータの評価まで−, サイエンティスト社 (1991).
8) H. V. Levinsky and M. A. Wilson : Food Cosmet. Toxicol., 13, 243 (1975).
9) J. M. Tesh et al. : Studies in rats fed a diet incorporating irradiated wheat, International project in the field of food irradiation, pp.1-64, Techinical report series IFIP-R 45, October (1977).
10) 田中憲穂 : 照射コムギ粉飼料給餌によるチャイニーズ・ハムスターおよびラット骨髄細胞に置ける倍数性細胞の誘発と末梢赤血球中の小核誘発, 食品照射委員会・研究成果最終報告書, 日本アイソトープ協会, 212-219 (1992).
11) 坂本京子 : ガンマ線照射スパイス・マンゴーの変異原性, 食品照射委員会・研究成果最終報告書, 日本アイソトープ協会, 205-211 (1992).
12) 川岸舜朗 : ガンマ線照射糖液の変異原性およびその抑制, 食品照射委員会・研究成果中間報告書, 日本アイソトープ協会, 119-130 (1989).
13) 祖父尼俊雄, 石館基 : 照射グルコースのチャイニーズ・ハムスター細胞による染色体異常試験, 食品照射委員会・研究成果中間報告書, 日本アイソトープ協会, 131-146 (1989).
14) 坂本京子, 岩原繁雄 : 照射食品および照射グルコースのサルモネラを用いる変異原性試験, 食品照射委員会・研究成果中間報告書, 日本アイソトープ協会, 147-162 (1989).
15) 祖父尼俊雄, 石館基 : ガンマ線照射グルコースについての変異原性試験, 食品照射委員会・研究成果最終報告書, 日本アイソトープ協会, 150-181 (1992).
16) 坂本京子, 岩原繁雄 : ガンマ線照射グルコースの変異原性, 食品照射委員会・研究成果最終報告書, 日本アイソトープ協会, 182-191 (1992).
(2004 年 8 月 9 日受理)
|
|