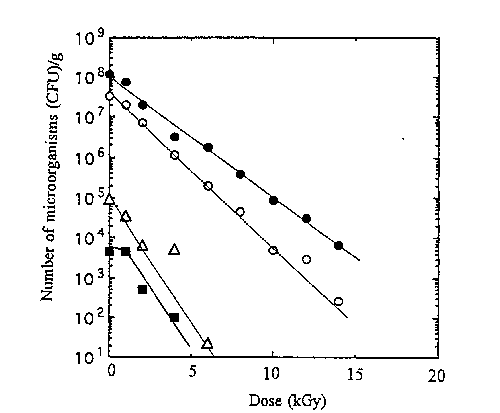
fig.1 Inactivation curves for microorganisms in sample No.S18 after gamma-irradiation. Symbols:●,total serobic bacteria:○,coliform bacteria;■,fungi;△,osmophilic molds
 |
植物等から得られる生薬には微生物汚染の著しいものが多く,日和見感染の原因になることも考えら れる。また,生薬によっては収穫後の貯蔵・流通中に糸状菌が増殖してマイコトキシン産生による汚染 の可能性もある。生薬は自然界からの産物のため,収穫前から様々な微生物が共生または付着してお り,たとえ,良好な衛生条件下で収穫・貯蔵しても微生物の汚染は防止できない。近年,生薬等の衛生 規準がきびしくなってきており,なんらかの殺菌処理が必要になってきている。しかし,生薬を酸化エ チレン等の薬剤で処理すれば毒性物質の残留が問題になるし,蒸気殺菌の場合には薬効成分の低減が問 題になる。香辛料の場合には汚染微生物は7~10kGyで殺菌され糸状菌の増殖も防止でき,精油成分や抗 菌性,抗酸化性もほとんど変化しない1~5)。植物由来の生薬も香辛料と成分的に類似しているため,照射 による成分変化は少ないと思われるが,放射線殺菌効果についてはほとんど検討されていない。
本研究では植物由来の生薬について微生物汚染の実態と放射線殺菌効果について検討した。
植物由来の生薬31試料(Table1,2):ケィヒ(試料NO.;S1),マオウ(S5),シャクヤク(S6,S13), ウイキョウ(S7)カゴソウ(S8),ダイオウ(S9,S11,S12),シユクシャ(S15),カンゾウ(S13,S16,K1, K2,K3,K4),ショウマ(S18,S28),シャゼンソウ(S19),インチコウ(S21),ソヨウ(S22),ケイガ イ(S23),センナ(Se1,Se2,Se3,Se4,Se5,Se6,Se7,Se8)を生薬会社より入手し,一般好気性細菌,大腸菌群, 一般糸状菌,好浸透圧性糸状菌の汚染菌数を香辛料と同じ方法で調べた1)。一般細菌と大腸菌群の代表 的分離株の同定はBergey's Manual of Systematic Bacteriology,Vol.Ⅰ,Ⅱ(1987)に従って行い6),糸状 菌類についてはThe genus Aspergillus7)及びIllustrated genera of Imperfect Fungi8)を参考にした。 放射線殺菌効果1)は当研究所の約10万キュリーのコバルト-60ガンマ線源を用い,吸収線量はFricke線量計により測定した。
1. 生薬中の微生物分布
生薬中の好気性細菌数はTable 1及びTable 2に示すように1試料を除いて,1g中1.9×102~1.4×108 個検出された。大腸菌群は16試料より1g当たり6.9×102~4.3x106個検出された。試料S11のダイオウ については菌が全く検出されず,すでになんらかの殺菌処理が行われているものと思われる。生薬中の 好気性細菌の約50%はBacillus属で構成されており, B.pumilus, B.circulans, B.megaterium 等が多く検出 された。また,ErwiniaやEnterobacter,Acinetobacterも多く検出された。一方,大腸菌群の多くは土壌由 来と思われるEnterobacterであり,E.agglomeransやE.cloacae, E.intermediumが検出され,腸内申来と 思われるCitrobacterも若干検出された。
一般糸状菌は25試料より1g当たり6.3×101~1.5×105個検出され, 主な糸状菌はAspergillus flavus, A.flavus var. columnaris, A.ostianus, A.phoenicisで あり, PenicilliumやTricoderma, Alternariaも検出された。好浸透圧性糸状菌は1g当たり6.3×101~1.9 ×105個検出され,Aspergillus glaucus群とA.restrictus群で構成されていた。好浸透圧性糸状菌は低水分活 性下でも増殖可能であり,試料S15のシュクシャやS22のソヨウ,Se5のセンナは糸状菌の増殖が起こっ ていると思われる。また,一般糸状菌数が多いS8の力ゴソウやS15のシュクシャではA.flavus群の増殖 初期の状態を示していると思われる。
2. 生薬の放射線殺菌効果
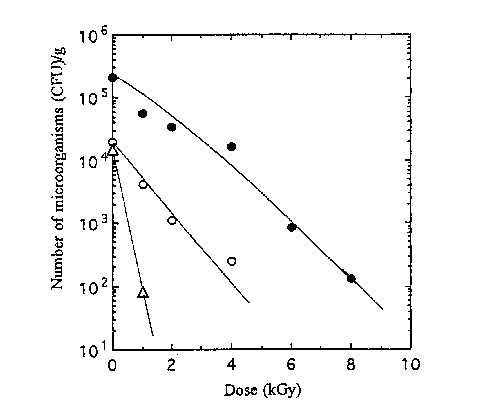
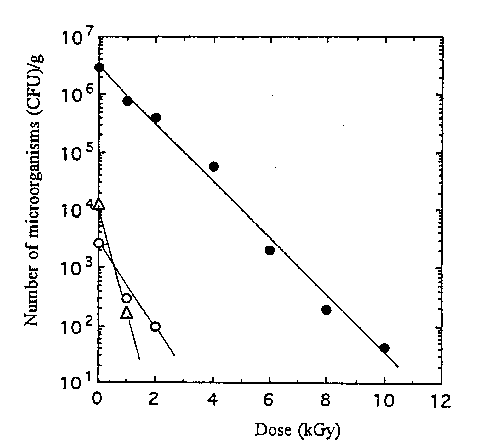
生薬30試料中,微生物汚染が最も著しいS18のショウマについて殺菌効果を調べたところ,Fig.1に示すように好気性細菌及び大腸菌群は15kGyでも多 くの生残菌が認められた。この場合,10kGy以上の高線量で生残している菌はAcinetobacterとEnterobacterであった。一方,糸状菌類は全て8kGy以下で殺菌 された。S17のカンゾウやK3のカンゾウの場合には, Fig.2及びFig.3に示すように10kGyでほぼ殺菌された。しかし,各試料とも大腸菌群は糸状菌に比べ放 射線耐性を示していた。なお,生薬中のBacillus属も10kGy以下で検出できなくなった。
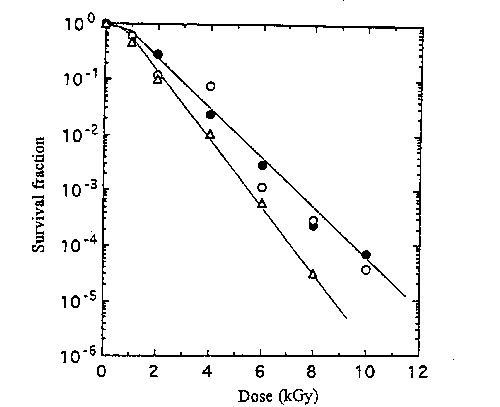
そこで,生薬からのEnterobacter分離株であるE.agglomerans K3-1とE.cloacae K3-2について0.067M燐 酸緩衝液中での放射線感受性を比較したところ,D10値はK3‐1株で0.25kGy,K3‐2株で0.35kGyとなり, Citrobacter分離株のD10値0.07kGyまたは比較に用い たEsxherichia S2株 のD10値0.12kGyの2~5倍あった。さらに,E.agglomerans K3-1株の定常期細胞をカンゾウ,ショウマ,センナ粉末中で凍結乾燥 して殺菌効果を調べたところ,Fig.4に示すようにカンゾウ,ショウマ中ではセンナに比べ放射線に耐性であった。従って,生薬によっては高線量でも大腸 菌群が生残する原因は大腸菌群がEnterobacterで主に構成されておりEscherichia coli等の糞便系大腸菌群に比べ放射線に著しく耐性であること及び乾燥生 薬中の放射線保護物質の存在によって説明可能である。
生薬の放射線殺菌で特に問題になる汚染微生物はマイコトキシン産生の可能性がある糸状菌類と衛生上問題になる大腸菌群であろう9)。Aspergillus属や Penicillium属の糸状菌はポリエチレン密封下の生薬でも増殖可能であり1),5kGy以下の線量で増殖を防止できると思われる。本研究で分離されたA.flavus やA.flavus var columnaris, A.ostianusはマイコトキシン産生の可能性があり,放射線殺菌によりこれらの菌の増殖抑制が可能である。なお,生薬中にはA. niger群に属するA.phoenicisと類似したコロニーを形成する Altenaria等の不完全菌が検出されることがあるが,本菌は放射線に耐性であり10kGy以上で も生残する可能性がある10)。しかし,不完全菌の多くは収穫前からの汚染菌であり,乾燥下での増殖は考えられない。
生薬の一般細菌及び大腸菌群の殺菌線量は香辛料に比べ大きい傾向が認められ,以前の予備的検討でも必要殺菌線量が15kGy以上を越えることが あった。香辛料の場合には構成菌が主にBacillus属で占められており,10kGy以下の線量で衛生規準まで殺菌することが可能であった。一方,生薬の場合に はAcinetobacherや大腸菌群が15kGyでも生残していることがある。しかし,高線量で生残している大腸菌群はEnterobacterであり,E.coliやSalmonellaが高 線量で生残する可能性は考えられない。事実,伊藤等が報告したように乾燥魚粉中でSalmonellaやE.coliは5kGyでほぼ殺菌される11)。また,ブドウ球菌 や緑膿菌等の多くの非芽胞形成細菌の放射線感受性もSalmonellaと同じであり低線量で殺菌可能である。Enterobacterは放射線に耐性であるが,衛生上 は特に問題のない菌であり,高線量で生残しても問題にならないであろう。また,Acinetobacterも衛生上の問題がない菌である。従って,生薬の殺菌線量を10kGyとしても 衛生的に問題がないと思われるが,簡易的な微生物検査で高線量照射後に大腸菌群が生残していることは問題であろう。Fig.1のよう な場合には必要殺菌線量は20kGyになると思われるが,糞便系大腸菌群検査により大腸菌群が1g当たりO個以下,好気性細菌数が103個以下とする場合 には必要殺菌線量は15kGyとなるであろう。また,Bacillus属等の有芽胞細菌と糸状菌,糞便系大腸菌群を衛生的な検査対象にすれば殺菌線量は10kGyで十 分と思われる。
生薬の放射線殺菌を実用化する場合には薬効成分の変化についても検討しておく必要がある。しかし,香辛料のように生薬と成分組成が類似している食品 類では精油等の成分変化はほとんど低下せず2~5),生薬での研究例でも薬効成分の低減は無視することができると思われる13)。
文献
1) Muhamed L,J.,H.Ito,H.Watanabe and T.Tamura:Agric.Biol.Chem.,50,347(1986)
2) 渡辺 宏,S.Bagiawati,田村直幸:食品照射,20,27(1985)
3) 金子信忠,伊藤 均,石垣 功:日食工誌,38,1025(1991)
4) H.Ito and M.S.Islam:Radiat.Biol.Chem.,43(6),595(1994)
5) 伊藤 均, Gao Meixu:食品照射,29,1(1994)
6) J.G.Holt,et al (Ed.):Bergey's Manual of Systematic Bacteriology,Vol.Ⅰand Ⅱ,Baltimore,Williams and Wilkins,1986
7) K.B.Raper and D,I.Fennell:The genus Aspergillus,Baltimore,Williams and Wilkins,1965
8) H.L.Barnett:Illustrated genera of Imperfect Fungi,Minneapolis,Burgess PubIishing Company,1965
9) 倉田 浩,石関忠一,宇田川俊一:衛生試験所報告,96,1(1978)
10) 伊藤 均,大木由美,石垣 功:防菌防微,19,577(1991)
11) 伊藤 均,A.Begum,久米民和,武久正昭:農化,57,9(983)
12) 伊藤 均:食品照射,33,51(1998)
13) 木村提二郎,佐々木将博,近藤裕一,城 尚信,神岡俊隆,小出祐章:PADIOISOTOPES,30,669(1981)
| Sample No. |
Total aerobic bacteria |
Coliforms |
Fungi |
Osmophilic molds |
| S1 Cinnamomum cassia S5 Ephedra sinica S6 Paeonia lactiflora S7 Foeniculum vulgare S8 Prunella vulgaris var. lilucina S9 Rheum palmatum S10 Foeniculum vulgare S11 Rheum palmatum S12 Rheum palmatum S13 Paeonia lactiflora S15 Amomum xanthioides S16 Glycyrrhiza uralensis S17 Glycyrrhiza uralensis S18 Cimicifuga simplex S19 Plantago asiatica S20 Cimicifuga simplex S21 Artemisia capillaris S22 Perilla frutescens S23 Schizohepeta tenuifolia |
2.5 ×10E+3 5.19×10E+3 1.88×10E+2 7.13×10E+5 2.79×10E+6 1.34×10E+4 1.94×10E+4 - 1.31×10E+3 9.38×10E+2 8.75×10E+6 1.64×10E+4 2.13×10E+5 1.38×10E+8 6.25×10E+4 2.59×10E+6 2.53×10E+6 1.79×10E+6 2.99×10E+4 |
- - - 6.63×10E+5 7.08×10E+4 - 1.38×10E+4 - - - - 1.50×10E+3 1.64×10E+4 4.25×10E+6 - 6.88×10E+2 3.79×10E+5 3.38×10E+3 - |
- 2.50×10E+2 - 6.88×10E+2 2.16×10E+4 4.17×10E+4 6.50×10E+3 - 7.50×10E+2 6.25×10E+1 9.58×10E+4 1.25×10E+2 3.13×10E+2 2.08×10E+4 - 6.30×10E+1 3.75×10E+2 1.44×10E+3 1.13×10E+3 |
1.25×10E+2 6.25×10E+1 1.25×10E+2 4.38×10E+2 7.08×10E+4 1.03×10E+4 4.04×10E+3 - 1.01×10E+4 - 1.85×10E+5 - 3.13×10E+3 1.06×10E+4 2.20×10E+4 - 8.75×10E+2 1.25×10E+5 1.13×10E+3 |
| * -:below detection level |
| Sample No. |
Total aerobic bacteria |
Coliforms |
Fungi |
Osmophilic molds |
| Se 1 Se 2 Se 3 Se 4 Se 5 Se 6 Se 7 Se 8 K 1 K 2 K 3 K 4 |
8.50×10E+3 2.93×10E+4 3.36×10E+4 1.85×10E+4 7.50×10E+4 2.71×10E+4 2.38×10E+4 1.15×10E+4 3.03×10E+4 8.63×10E+5 7.50×10E+5 2.80×10E+4 |
- - 9.88×10E+3 6.25×10E+2 4.63×10E+3 1.50×10E+3 2.38×10E+3 - - 5.78×10E+4 3.50×10E+3 - |
1.25×10E+2 2.50×10E+2 4.00×10E+3 3.75×10E+2 1.54×10E+5 7.50×10E+2 3.75×10E+2 2.50×10E+2 - 4.88×10E+3 1.25×10E+2 - |
- - 4.88×10E+3 1.38×10E+3 1.17×10E+5 1.25×10E+2 1.25×10E+2 1.25×10E+2 - 4.30×10E+4 5.00×10E+3 5.00×10E+2 |
| Senna:Cassia sennae, Licorice:Glycyrrhiza uralensis |
 |
 |
 |
 |
|
|