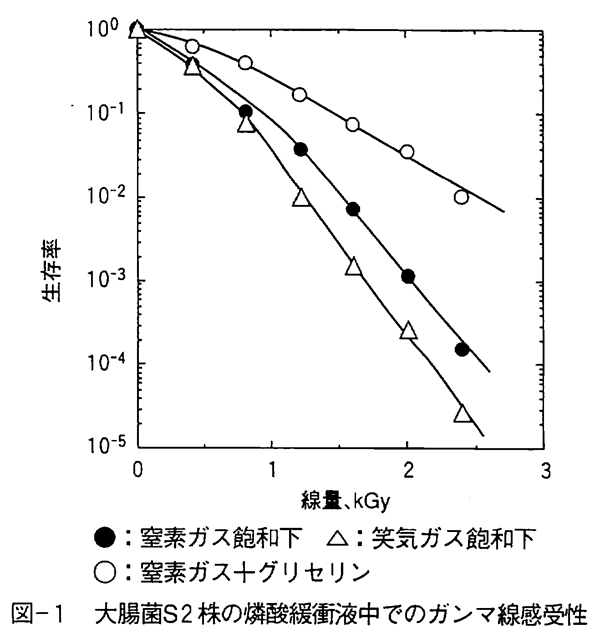
図-1 大腸菌S2株の燐酸緩衝液中でのガンマ線感受性
 |
かっては、生物に放射線が照射されるとゴジラのような巨大生物や凶悪な変異生物が発生すると一般の人々に恐れられていた。 食品照射の場合には危険な害虫が発生したり、人体に有用な食品中の微生物が放射線で殺菌され有害な微生物だけが生残するとか、突然変異によって危険な微生物が発生するとの危惧があった。 たとえば、1964年にわが国で玄米から放射線抵抗性細菌が発見されたとき、非照射米から約2kGyまでの照射米では玄米を覆う細菌類は黄色から黄白色のコロニー(集落)を寒天培地上に形成したのに対し、3〜5kGy以上では多くのコロニーが赤色のコロニーに変わった。 周囲に居た微生物学者達はこの現象を見て放射線による突然変異とうたがった。 しかし、冷静に眺めれば非照射玄米のコロニー中にも赤色コロニーがわずかながら混在していたし、形態学的性質や生化学的性質を調べたところ、非照射玄米から得られた赤色コロニーの菌も照射玄米から得られた菌でも差は認められず、グラム陰性の放射線抵抗性細菌であることがわかった。 すなわち、玄米で起こった現象は照射による微生物相(微生物の種類の構成、ミクロフローラとも言う)変化によるものであり、加熱処理より明確に現れることを示している。
食品の放射線処理は0.02〜50kGyの吸収線量によって、根茎菜類の発芽防止、果実の熟度調整、殺虫、消毒殺菌、完全殺菌、物性改良など薬剤処理や加熱に変わる広範囲な応用が可能である。しかも、薬剤のような残留性がなく、加熱と異なり生鮮状態で殺虫・殺菌ができるという利点がある。しかし、これらの応用は放射線からの恐怖感をなくすのに必要な放射線生物学の進歩、加熱など他の処理法との比較など様々な研究成果の総合の上に可能となったものである。ここでは、食品に関係する微生物等への照射の影響や微生物学的安全性を中心に解説する。
放射線の生物効果はDNAへのフリーラジカル(遊離基)の作用によって起こることは放射線生物学の進歩によって明らかになった。 しかし、X線が発見された直後の20世紀初頭でも放射線には生物に対する突然変異作用があることがわかっており、食品照射の場合にも害虫や微生物に放射線を照射すると突然変異が起こるものと見なされていた。 今日では微生物の突然変異は薬剤処理や紫外線、凍結乾燥、加熱処理でも起こることがわかっているが、食品照射研究初期の1960年代頃までは放射線抵抗性菌も突然変異で発生するのではないかと疑われていた。
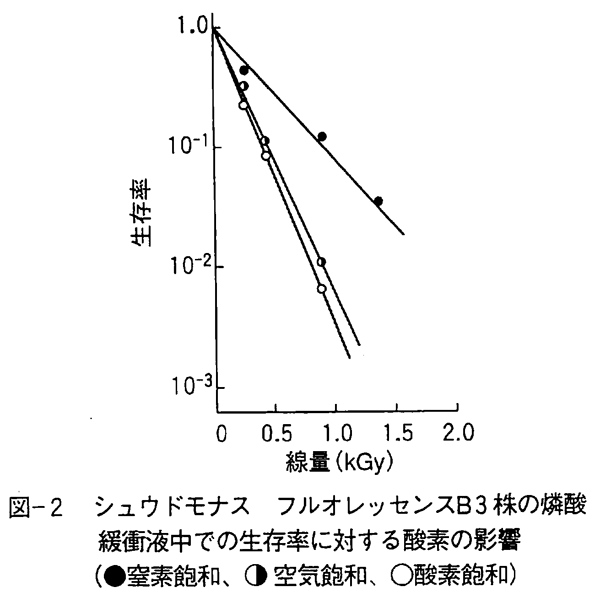
さて、生物の放射線障害は基本的にDNA鎖の切断であり、水の放射線分解で生成する活性酸素の水酸基ラジカル(・OH)が主に関与し、酸素が共存すると過酸化水素ラジカル(・HO2)やスーパーオキシドラジカル(・O2-)、過酸化水素(H2O2)などの活性酸素も関与することがわかっている。 活性酸素は生体内でも新陳代謝で絶えず発生しているが、水酸基ラジカルなどが殺菌などの生物効果に関与していることは図-1でも明らかである。ここでは、0.067M燐酸緩衝液中に懸濁した大腸菌細胞を窒素ガス飽和と笑気ガス(N2O)飽和で比較しているが、笑気ガス下で放射線による水酸基ラジカルの生成が約2倍に増加すると殺菌効果も促進されることがわかる。 また、窒素ガス飽和下でグリセリンを添加すると水酸基ラジカルがほとんど捕捉されるため、放射線の直接効果が中心となり著しく放射線に耐性となる。一方、酸素が存在すると窒素ガス飽和下に比べ約3倍殺菌効果が促進される(図-2)。 すなわち、水酸基ラジカルやスーパーオキシドラジカルなどの活性酸素は殺菌効果促進作用を有している。 乾燥された細菌やカビ胞子の場合でも酸素が共存すると比較的少ない線量で殺菌され、乾燥下でグリセリンなどの水酸基ラジカル等の活性酸素捕捉物質が共存したり、無酸素下で照射すると著しく放射線に耐性となる。 酸素による放射線感受性促進効果は癌細胞でも認められており、酸素供給量の少ない癌組織ほど放射線に耐性である。
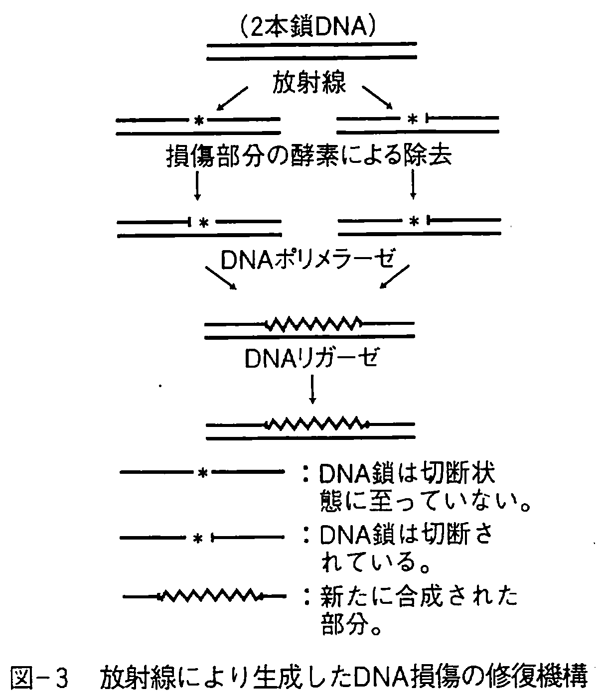
DNAは2本鎖で構成される巨大分子であり、DNAの1本鎖における放射線損傷は図-3に示すように一連の修復酵素系により容易に修復されるが、2本鎖の同じ部分が同時に損傷を受けると修復の不完全または失敗が起こりやすくなり、細胞分裂能が失われたりDNAを構成する塩基の一部が欠失または他の塩基と入れ替わることによる突然変異を引き起こす。 しかし、突然変異の比率は著しく少なく、その大部分は細胞分裂能が失われることによる細胞死である。また、突然変異が起こったとしても細胞内での自動的なDNAの組み替えにより元にもどることが多い。 なお、紫外線での生物効果もDNA損傷が中心であるが、DNA鎖の損傷は構成塩基の一つであるチミンが二量体化することが主に原因しており、突然変異発生や損傷DNAの修復過程は放射線損傷の修復と似ている。
生物に対する放射線の影響は表-1に示すように高等生物に対しては少ない吸収線量で大きな生物効果をもたらすが、下等生物の場合には多量の線量が必要である。 すなわち、生物に対する放射線の影響は細胞中のDNA含量に反比例しており、細胞当たりのDNA含量が小さいほど放射線に耐性となる傾向がある。 細胞中のおおよそのDNA含量は細菌を1とすると、ウイルスで0.01〜0.1、カビ(糸状菌)や酵母菌で10、昆虫で20、哺乳動物で1,000、植物で1,000〜5,000である。 なお、食品や生体内に含まれる酵素類は放射線に著しく安定であり、完全殺菌された生鮮食品でも酵素活性は残っている。また、狂牛病のプリオンも酵素と同じタンパク質の一種のため放射線に著しく耐性である。
微生物の場合、芽胞(胞子)形成細菌や放射線抵抗性菌は一般微生物に比べ放射線に対する耐性が著しく強い。すなわち、多くの病原性細菌やカビの仲間は1〜5kGyで殺菌されるのに対し、芽胞形成細菌や放射線抵抗性菌は10kGy以上照射されないと殺菌できない(表-2)。 細菌芽胞が放射線に耐性の理由は主に芽胞中のDNAが乾燥下と同じ状態にあり、周囲をフリーラジカル捕捉物質で覆われていることが主に関係している。 放射線抵抗性菌の場合にはDNA修復酵素系が異常に発達していることが放射線耐性の主な原因になっていると思われる。 なお、細菌芽胞は熱にも耐性であり、100℃で1時間加熱しても完全殺菌できないが、放射線抵抗性菌は熱には耐性が低い。 なお、表-1に示すようにウイルスや酵素は放射線に著しく耐性であるが、熱に対しては一般細菌と同様に65℃・30分で活性を失うものが多い。
 |
 |
 |
 |
 |
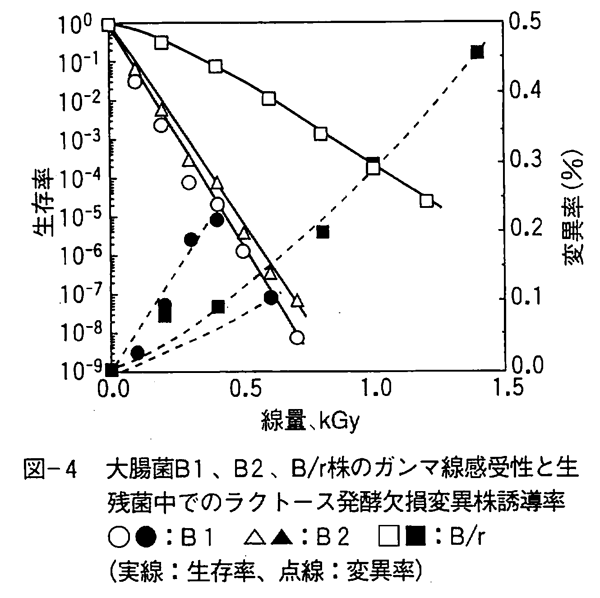
食品を放射線照射する場合、生き残った微生物が突然変異によって病原菌などの有害菌に変わったり、薬剤耐性菌と同じように放射線に耐性となるかどうかを明らかにしておく必要があった。 放射線により誘発される突然変異のほとんどは紫外線やアルキル化試薬などの作用と同様にDNAの修復ミスによって起こる欠損変異であり、巨大細胞が出現したり異なった種類の新たな遺伝子が誘導される可能性はほとんどない。 すなわち、遺伝子操作のように外部からの新しい遺伝子を取り入れることによる変異とは異なり、遺伝子の一部が欠損または置換することによる変異である。 大腸菌についてガンマ線と紫外線による乳糖発酵能欠損変異誘発について調べたところ、両者とも突然変異誘発率は大差がなく図-4に示すように生存率が10−6程度の線量でも0.01〜0.5%であった。 また、アミノ酸合成欠損変異も同程度誘発されたが、変異の多くは不安定で簡単に変異前の状態にもどってしまった。 一方、サルモネラ・タイフィムリウム(ネズミチフス菌)を生存率10−6程度になるまで照射して、生き残った菌を同じように培養して5回繰り返して10-6程度になるように照射したが、放射線に対する耐性増加はなかった。 さらに、照射を繰り返すと一部の細胞が放射線に耐性となったが、これは単細胞が分裂能を失って菌糸状になったために起こった現象であり、これらの菌体を照射せずに繰り返し植え次ぐことにより菌糸状細胞は消失し放射線感受性も元の状態に復帰した。 また、6回以上の繰り返し照射を行うと栄養要求性変異株が増加したが、サルモネラの血清型(分類のための指標)は変化しなかった。 Davisらもサルモネラ・タイフィムリウムを84回繰り返し照射したが同じ様な結果を得ている。なお、放射線に比較的抵抗性の強いサイクロバクター(旧Moraxella-AcinetobacterまたはAchromobacter)について放射線耐性株の粗DNAを1/6程度耐性の感受性株に転移させたがアミノ酸合成能等の遺伝子の転移は認められたが放射線耐性の増加は認められなかった。 このことは、放射線耐性の遺伝子が他の微生物に移行することは自然界では簡単には起こり得ず、薬剤耐性菌の核外遺伝子(プラスミド)が他の菌に転移する現象とは異なっていることを示している。 また、抗生物質耐性細菌などの放射線感受性は非耐性細菌と同じか高感受性であり、照射による抗生物質耐性変異株の出現もなかった。
アフラトキシン(強力な発癌物質)などのカビ毒を産生するカビを照射すると産生量が2〜3倍に増加する変異株も出現することがあるが、変異株の90%以上は毒素産生能が低減するか失われてしまう。 毒素産生能が増大する変異株の出現率は1〜5%程度であり、増大した変異株も純粋分離しないで植え次ぐと毒素産生能は変異前と同じ程度に低下してしまう。 ウイルスの場合も放射線によるDNA型またはRNA型の損傷は紫外線と似ており、しかも放射線に著しく耐性のためウイルスの病原性が大きく変化する可能性はほとんどない。 昆虫や植物の場合も放射線による突然変異は生存競争力が弱い劣性変異が圧倒的に多い。
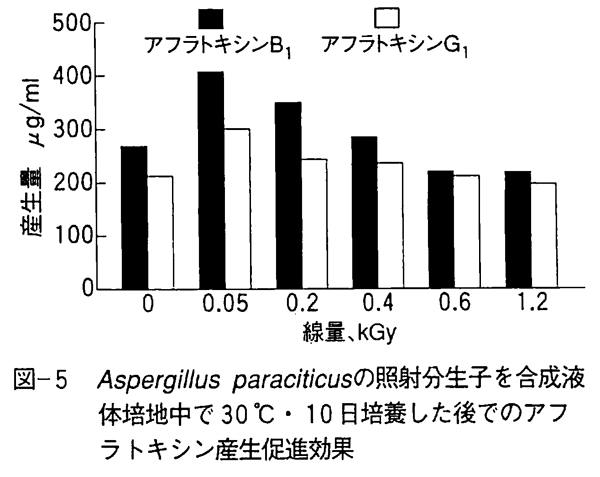
かって、インドの研究でアフラトキシンを産生するカビを蒸気滅菌した小麦に接種した後でガンマ線を0.5〜2.5kGy照射し、培養すると非照射に比べてアフラトキシン産生量が1.5〜2.0倍増加することが報告され、国際的に大きな問題となった。 この報告に対して、カビ胞子の接種量説や突然変異説などが出されたが明確な結論は出されなかった。 わが国の研究では蒸気滅菌された白米や黒コショウ、赤トウガラシにアフラトキシン産生カビを接種してからガンマ線を1kGy照射すると非照射に較べアフラトキシン産生量が赤トウガラシ、黒コショウ、白米の順に1.1、1.7、1.9倍と増加し、これは澱粉の低分子化等の成分変化が関係していると結論づけている。 なぜなら、アフラトキシン産生カビを蔗糖を多く含む液体合成培地に接種してからガンマ線を照射すると図-5に示すように低線量の0.05kGyで刺激効果によりアフラトキシン産生量が約1.5倍に増大したが、0.4kGy以上では産生量が低減しているからである。 なお、低線量でアフラトキシン産生量が増加するのはホルミシス効果によるものであり紫外線などの物理作用でも起こる現象であり、次世代には継続されないことも確認されている。 また、ボツリヌス菌のC型菌やB型菌について毒素産生促進効果を調べたが促進効果は認められなかった。 腸管出血性大腸菌 O157:H7の多くの分離株でも照射によるベロ毒素産生促進効果は認められていない。
放射線抵抗性菌としては細菌のデイノコッカス・ラジオジュランス(旧Micrococcus radiodurans)やメチロバクテリウム・ラジオトレランス(旧Pseudomonas radiora)などが知られているが、これらの菌は突然変異で誘発されたものではない。 また、これらの菌は病原性がなく毒素産生能もなく、一般細菌に比べ増殖が遅く食品の腐敗力も強力ではない。 酵母菌でも黒酵母菌やトリコスポロン・オリーゼなどが知られているが、植物寄生菌であり食品の変敗にはあまり関与していない。 したがって、これらの放射線抵抗性菌が高線量照射後に生き残ったとしてもあまり問題ではないし、耐熱性も低い。なお、芽胞形成細菌も放射線に耐性であるが、10℃以下の低温貯蔵では生育が困難な菌が多く、しかも3〜5kGy程度照射後の低温貯蔵では照射損傷の修復が困難なためあまり問題にならないであろう。
 |
 |
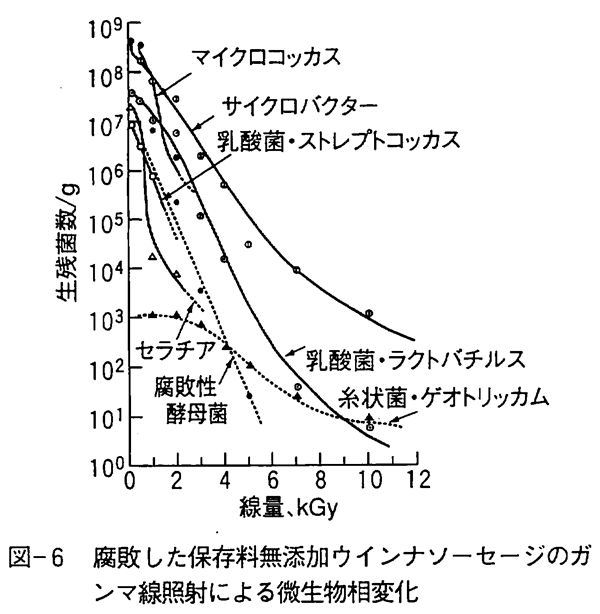
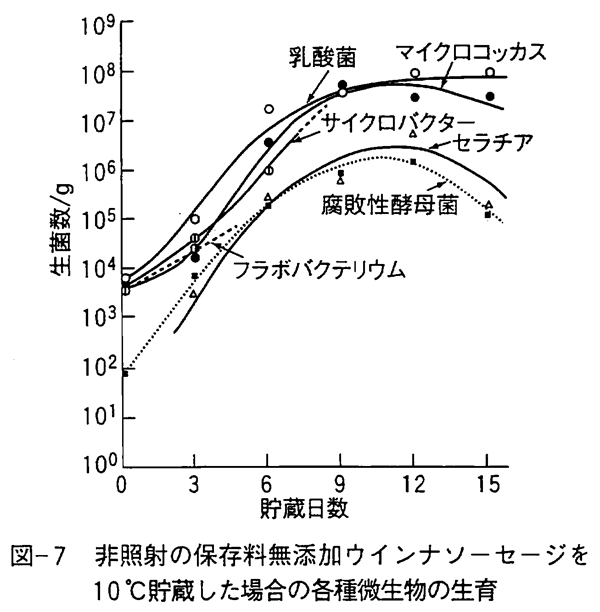
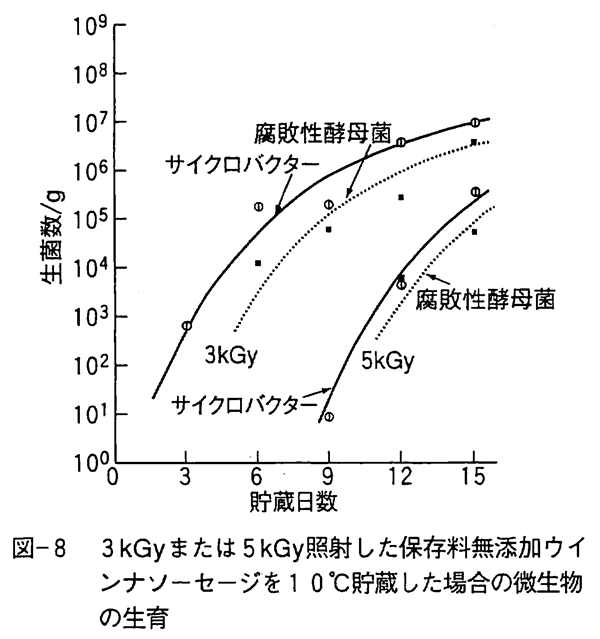
放射線による消毒殺菌は菌数低減による貯蔵期間延長または病原菌の殺菌を目的としており必要殺菌線量は10kGy以下であり、完全殺菌でないため微生物相変化によって有害な微生物が照射後に優先的に増殖するかどうかを明らかにしておく必要があった。 生鮮食品の放射線消毒殺菌は10℃以下での低温貯蔵との組み合わせが多い。低温貯蔵で肉類や魚介類の腐敗に関与する微生物は主にシュウドモナス、フラボバクテリウム、マイクロコッカス、アシネトバクター、乳酸菌、サイクロバクター(旧AchromobacterまたはMoraxella-Acinetobacter)などの腐敗性細菌類と数種類の腐敗性酵母菌である。 たとえば、保存料無添加の腐敗初期のウインナソーセージにガンマ線を照射すると図-6に示すような微生物相変化を示す。 食肉中では大腸菌群に属する大腸菌やセラチア等の細菌やマイクロコッカス、シュウドモナス、フラボバクテリウムなどの腐敗性細菌の多くは2〜3kGyで菌数が急減し、腐敗性酵母菌や乳酸菌も4〜6kGyで菌数が著しく低減する。 これに対して、放射線に比較的耐性の強いグラム陰性のサイクロバクターは10kGy以上の高線量でも生残し、ゲオトリッカムと呼ばれる不完全糸状菌(カビ)も少ない菌数ながら高線量でも生残している。食肉や魚介類の多くは2kGy以上照射して10℃以下で貯蔵するとサイクロバクターと腐敗性酵母菌が増殖してくる。 図-7は保存料無添加の非照射ウインナソーセージに増殖してきた微生物群であり、図-8は3kGyまたは5kGy照射したウインナソーセージの微生物群である。 照射ウインナーソーセージに生残して増殖するサイクロバクターや腐敗性酵母菌のカンデイラやトルロプシス、ロドトルラなどの菌は他の腐敗菌に比べ増殖速度が遅く、病原性も報告されていない。 また、これらの腐敗菌は図-7に示すように非照射の肉類等を低温下で貯蔵しても発生することが知られている。 なお、食中毒性細菌の多くは1〜3kGyで殺菌されるため、低温貯蔵による食中毒の発生は起こらないであろう。
一方、食肉加工品や魚肉加工品では香辛料等の添加物からの汚染微生物の影響が出ることがある。 たとえば、保存料無添加のウインナソーセージでも製造条件が異なると耐熱性の食中毒性有芽胞細菌のセレウス菌が10℃の保存条件で非照射品に優先的に増殖してくることがある。 セレウス菌などの芽胞形成細菌は放射線に耐性のため10kGy以下の照射食品に増殖してくると思われる。 しかし、保存料無添加ウインナソーセージを3kGy照射して10℃で貯蔵した場合にはセレウス菌の増殖は認められなかった。 この原因はセレウス菌芽胞の放射線損傷が低温では修復されにくいためと思われる。 一方、20℃貯蔵では3kGy照射でもセレウス菌の急速な増殖が認められている。 食中毒菌のボツリヌス菌やウエルシュ菌などの嫌気性有芽胞細菌も高線量照射した食肉加工品や魚介類に増殖してくる可能性があるが、10℃以下の低温貯蔵と組み合わせれば増殖は抑制されると思われる。
乾燥食品の場合にはアスペルギルス属やペニシリウウム属の好浸透圧性のカビ類によって腐敗が起きるが、照射によって毒素産生カビが優先的に生残することはなく、水分含量を約12%以下と少な目に維持して2〜5kGy照射すればカビの発生を抑制できるであろう。
完全殺菌への応用は肉類が中心であり30〜50kGyの高線量が必要であり、微生物相変化は関係ない。
 |
 |
 |
本章では微生物の放射線感受性と照射後に生き残る食品微生物等の安全性について主に解説した。 医療用具の放射線滅菌の場合には生き残る微生物は基本的にいないので主に滅菌線量と材質への照射の影響について調べれば良かったが、食品照射では0.02kGy程度の低線量から50kGyの高線量までの様々な応用分野があり、照射後に生き残る微生物等の安全性が問題になる。 照射食品の安全性評価では動物を使った飼育試験が大きな比重を占めるが、食品の照射後に生残する生物の突然変異や有害生物が優先的に生き残るかどうかの問題も明らかにしておく必要があった。 たとえば、1956年に発見されたグラム陽性の放射線抵抗性細菌デイノコッカス・ラジオジュランスも発見当時は突然変異で発生したものであると国際微生物学会関係で考えられており、わが国でグラム陰性の放射線抵抗性細菌が非照射玄米からも発見されたころから突然変異発生説は消えていった。 また、照射後の微生物相変化では有害菌が生き残ることが心配された。たとえば、原子力特定総合研究でウインナソーセージを3〜5kGy照射後にサイクロバクターが生残することが見出されたとき、米国でも生鮮肉で同じような現象が見出された。当時はサイクロバクターの分類的な位置付けも混乱しており、病原菌のモラクセラ属に入れるか、腐敗菌のアシネトバクター属に入れるか意見が分かれていた。 しかし、本菌は低温性細菌であり30℃以上では増殖できず、5〜10℃での生育が活発であることから、腐敗菌としてのサイクロバクター属が新たに設けられた。 このように、微生物学的安全性の問題は食品照射実用化の上で重要であったにもかかわらず、わが国の原子力特定総合研究では重要視されず、(財)日本アイソトープ協会の食品照射委員会でようやく取り上げられた。 わが国の微生物学的安全性の研究は主に日本原子力研究所が中心になって行われ、諸外国でも個々の研究者によって行われてきた。国際的に微生物学的安全性の研究成果がまとめられたのは1999年に出版されたWHO(世界保健機関)の「10kGy以上の照射食品の健全性評価」においてである。 現在でも多くの人達は微生物の突然変異は放射線で簡単に発生すると思っているようであるが、通常の照射条件下では突然変異発生率は著しく低く、紫外線や薬剤と同じ程度であることがわかっている。 次回は食品照射の重要な応用分野である放射線による野菜の発芽抑制効果と殺虫・殺菌効果および衛生化について述べる予定である。
1) 中山 勉、児玉昌彦:化学と生物、23, 771 - 778(1985)。
2) H.デルデインガー、H.ユング(代谷次男、天笠淳平訳):”放射線生物学”、東京大学出版会、1974。
3) 伊藤 均:大腸菌及び関連細菌の放射線感受性に及ぼすフリーラジカルと培養基の影響、食品照射、35、1 - 2(2000)。
4) 瀧上真智子、伊藤 均:Escherichia coliのガンマ線および紫外線感受性と突然変異誘発について、食品照射、30、11 - 16(1995)。
5) 伊藤 均、他:繰り返し照射によるSalmonella typhimuriumの放射線抵抗性の誘導、食品照射、24、12 - 15(1989)。
6) R. Davies and A. J. Sinskey : Radiation-resistant mutants of Salmonella
typhimurium LT2 : Development and chracterization, J. Bacteriol., 113, 133
- 144(1973).
7) H. Ito and H. Iizuka : Genetic transformation of Moraxella-like psychrotrophic
bacteria and their radiation-sensitivity, Agric. Biol. Chem., 47, 603 - 605(1983).
8) E. Priyadarshini and P. G. Tulpule : Effect of graded doses of γ-irradiation
on aflatoxin production by Aspergillus parasiticus in wheat, Food & Cosmics
Toxicology, 17, 505 - 507(1979).
9) G. E. Mitchell : Influence of irradiation of food on aflatoxin production,
Food Technology in Australia, 40, 324 - 326(1988).
10) 伊藤 均、他:Aspergillus parasiticusとAspergillus flavusのアフラトキシン産生に及ぼす低線量照射の影響、食品照射研究委員会研究成果報告書、235
- 244、日本アイソトープ協会、1992。
11) 小崎俊次、坂口玄二:ボツリヌス菌芽胞に対するガンマ線照射の影響、食品照射研究委員会研究成果報告書、224 - 234、日本アイソトープ協会、1992。
12) 菊池 裕、伊藤 均、他:低線量放射線による微生物毒素産生能の変化に関する研究1,ベロ毒素を産生する腸管出血性大腸菌Escherichia coli
O157:H7に及ぼす影響、食品照射、36、23 - 25(2001)。
13) J. W. Drake(鈴木けんし監訳):突然変異の分子生物学、丸善株式会社、1973。
14) A. W. Anderson, et al. : Studies on a radio-resistant micrococcus 1. The
isolation, morphology, cultural characteristics and resistant to gamma radiation,
Food Technol., 10, 575 - 577(1956).
15) H. Ito and H. Iizuka : Taxonomic studies on a radio-resistant Pseudomonas,
Agric. Biol. Chem., 35, 1566 - 1571(1971).
16) H. Ito, et al. : A new radio-resistant yeast of Tricosporon oryzae nov.
sp. isolated from rice, Agric. Biol. Chem., 38, 1597 - 1603(1974).
17) H. Ito, et al., Isolation and identification of radiation-resistant cocci
belonging to the genus Deinococcus from sewage sludges and animal feeds, Agric.
Biol. Chem., 47, 1239 - 1247(1983).
18) C. J. Dean, et al., : Repair of X-ray damage to the deoxyribonucreic acid
in Micrococcus radiodurans, Nature, 209, January 49 - 52(1966).
19) S. Kitayama and A. Matsuyama : Double-strand scission in DNA of gamma-irradiated
Micrococcus radiodurans and their repair during postirradiation incubation,
Agric. Biol. Chem., 35, 644 - 562(1971).
20) 伊藤 均、他:放射線抵抗性細菌Pseudomonas radioraの放射線感受性と放射線損傷からの回復、日本農芸化学会誌、46、127 -
135(1972)。
21) H. Ito and T. Sato : Changes in the microflora of vienna sausages after
irradiation with gamma-rays and storage at 10℃, Agric. Biol. Chem., 37, 233
- 242(1873).
22) FAO/IAEA/WHO Study Group : High-dose irradiation ; Wholesomeness of food
iradiated with doses above 10kGy, WHO Report 890, Geneva, 1999.
|
|