第(2)−1図 玉ねぎ縦断図
 |
ガンマー線照射により、玉ねぎの発芽抑制を行なう場合、試料とする玉ねぎの熟成の度合ならびに収穫後の保存方法により発芽抑制効果に変動の生じるおそれがある。そこで収穫時期を異にし、また適期に収穫してその後の保存温度を異にした試料について、7および15krad照射後の発芽抑制状態を観察した。
札幌市東区東苗穂町産の玉ねぎ(札幌黄)(播種3月20日、移植5月10日。収穫適期9月7日)で、適期4週間前および2週間前のものはM球(横径5.8〜7cm)、適期および2週間後のものはL球(横径7〜9cm)を用いた。
収穫適期(9月7日)、適期4週間前(8月10日)、適期2週間前(8月24日)、および適期2週間後(9月21日)にそれぞれ収穫した玉ねぎ(札幌黄)を1週間風乾してから7および15kradのガンマ線照射[北海道大学設置のCo−60γ線照射装置、線量率、3×4×10・E(3)rad/hr]を行なった後、室温(15〜25℃)および低温(約4℃)に貯蔵し、試料の熟度と発芽抑制効果との関係を調べた。
各試験区50個ずつ用い、6〜7カ月貯蔵を行ない、1、2、3、4、5、6および7カ月後にそれぞれの試験区について発芽および腐敗の有無を鱗茎の外部から調べた。
試料の熟度と発芽抑制効果については、非照射、7および15krad照射区を、室温(15〜25℃に調節された暗室)および低温(約4℃)に6〜7カ月貯蔵し、1、2、3、4、5、6、および7カ月後にそれぞれの試験区における発芽率を第(2)−1表に示した。
適期および適期2週間後収穫の試料では、7および15krad照射によって、室温貯蔵においても、非照射区が6カ月後に50%前後発芽しているのに対して完全に抑制することができた。しかし適期4週間前および適期2週間前収穫の試料では、照射による発芽抑制効果がかなり認められるが、完全ではなかった。また、1週間の風乾では乾燥が不十分であったかも知れないが、非常に高く腐敗率を示した。なお、低温室はやや湿度が高く、室温貯蔵のための暗室はやや乾燥気味であった。
適期および適期2週間後収穫の試料、すなわち完熟玉ねぎ(札幌黄)鱗茎は、非照射室温貯蔵においても3〜4カ月は休眠を続け、5カ月目に破れ出すと見ることができよう。収穫時期すなわち熟度は非照射玉ねぎの貯蔵性対して重要であるが、ガンマ線照射による発芽抑制効果に対しても非常に重要でしかも臨界的因子と考えられる。
| 貯 蔵 方 法 |
収穫時期 |
線量 |
発 芽 率 % |
||||||
| 1 |
2 |
3 |
4 |
5 |
6 |
7 |
|||
| 室 温 貯 蔵 |
適期4週間前 |
0 7 15 |
2 0 0 |
2 0 0 |
10 4 4 |
24 4 4 |
32 4 4 |
40 4 4 |
50 4 4 |
| 適期2週間前 |
0 7 15 |
0 0 0 |
2 0 0 |
6 0 0 |
10 0 0 |
14 0 0 |
28 0 0 |
38 0 0 |
|
| 適 期 |
0 7 15 |
0 0 0 |
0 0 0 |
8 0 0 |
14 0 0 |
30 0 0 |
40 0 0 |
− − − |
|
| 適期2週間後 |
0 7 15 |
0 0 0 |
0 0 0 |
2 0 0 |
8 0 0 |
44 0 0 |
62 0 0 |
− − − |
|
| 低 温 貯 蔵 |
適期4週間前 |
0 7 15 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
2 0 0 |
4 0 0 |
4 0 0 |
| 適期2週間前 |
0 7 15 |
0 0 0 |
2 0 0 |
2 0 0 |
2 0 0 |
4 0 0 |
6 0 0 |
6 0 0 |
|
| 適 期 |
0 7 15 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
− − − |
|
| 適期2週間後 |
0 7 15 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
0 0 0 |
− − − |
|
6月5日に収穫した泉州中高(L球、重量300〜190g、横径10〜8cm)を泉南農業協同組合より6月20日に入手し、外観的に良質球を選別して試料とした。
上記試料は6月24日に大阪府立放射線中央研究所において、コバルト60ガンマ線を20krad/hrの線量率で7kradおよび15kradを照射した。また試料の一部は室温下および冷蔵下(0℃)に3カ月間貯蔵後に上記線量を照射した。冷蔵はボール箱詰めとし、室温貯蔵はポリエチレン製カゴに並べて行なった。照射した玉ねぎは主として室温に、一部は15℃において照射効果を試験した。発芽率は外観上球より芽がでたものを発芽球として求めた。また球を切断し内部の状態を観察し、その状況は写真に撮った。
発芽抑制効果は、第(2)−2と第(2)−3表に示した。収穫当初、すなわち休眠中に照射した場合には、7kradおよび15kradいずれの線量でも発芽は完全に阻止された。室温下で3カ月貯蔵後(内芽が伸長し始めている時)に照射した場合は、7kradおよび15krad区とも約50%発芽した。ただし、冷蔵(0℃)下で3カ月貯蔵したものでは、7krad区でわずかに発芽(3%)したのみであった。しかしこれらの一旦発芽した芽は照射後1〜2カ月間に枯死した。15kradでは、完全に発芽は抑制された。発芽抑制された玉ねぎの内芽はすべて褐変した。その程度は収穫当初休眠中に照射したものと3カ月冷蔵後照射したものでは極小部分に限られ枯死状態であるが、室温貯蔵3カ月後に照射したものでは褐変部分が大きくかつ湿潤で、明らかに品質の低下が認められた。また照射玉ねぎで一旦発芽した後その芽が枯死したものでは内部の褐変部位はより一層大きく、腐敗球とほとんど区別ができない状態あった。このような内芽の褐変程度は7kradと15kradの間に差異は認められなかった。
以上は照射後室温に貯蔵した場合の試験結果であるが、一部の照射玉ねぎ試料につき照射後15℃における発芽状態を試験し、上記室温の場合と同様の結果を得た。すなわち玉ねぎ泉州黄(泉州中高)を収穫直後に7および15kradを照射した場合は、15℃においても全く発芽しない。3カ月室温貯蔵後に7および15kradを照射し15℃においた場合は照射後2カ月で、それぞれ36.6%および34.5%の発芽がみられた。
以上の結果から玉ねぎの発芽抑制を対象としたガンマ線照射は、収穫後休眠中に可及的速やかに行なった方が発芽抑制効果は大きく、照射までにある一定期間保存を必要とする場合は冷蔵(0℃)下で休眠期間を強制的に延長させることが必要と考えられる。休眠状態にある場合の発芽抑制に対する有効線量は7kradでよいと認められる。
| 線量(krad) |
6月24日 |
10月7日 |
10月28日 |
11月15日 |
2月22日 |
| 対 照 区 7 15 |
% 0 0 0 |
6.1 0 0 |
15.6 0 0 |
51.8 0 0 |
100.0 0 0 |
| 線量(krad)と区 |
9月26日 |
10月28日 |
11月24日 |
2月22日 |
|
| 室 温 貯 蔵 |
対 照 区 7 15 |
0 % 0 0 |
14.3 12.0 10.4 |
46.8 29.8 34.1 |
94.8 52.6 46.5 |
| 冷 蔵 |
対 照 区 7 15 |
0 0 0 |
16.0 0 0 |
41.0 0 0 |
89.0 3.0 0 |
前述のように放射線の玉ねぎに対する発芽抑制効果は、試料玉ねぎが完熟した適期に収穫され休眠中である場合に大きい。照射試料が実際にこのような照射に適した状態にあるか否か、またあらかじめ、適当な照射時期であることを予測できるか否かを検討するため、内芽の組織学的変化およびカロチノイド色素と還元性物質の含有量の変化ならびに各収穫時期における糖含有量の相違を検討した。
前記1.−(1)と同じく「札幌黄」の(イ)収穫適期、(ロ)収穫適期の2週間前、(ハ)4週間前の3時期に堀り上げたもの。
(a)照 射
試料(イ)〜(ハ)それぞれ収穫後約10日目に日本アイソトープ照射協同組合(栃木県都賀町)のCo−60γ線照射装置で7,000および15,000rad照射した。
玉ねぎ各球に対する照射線量の差を可及的少なくするため、左右に並んだ照射線源のほぼ中央を通過するように、また玉ねぎの芽を上にほぼ垂直に1列に固定して照射した。
(b)貯 蔵
上記(イ)〜(ハ)の照射品および対照として(イ)〜(ハ)の非照射品を15℃の恒温室に貯蔵した。
(c)固 定
照射直後から組織変化の明確に認められた時期まで1週間毎に各試料区について数球ずつ、玉ねぎ球のりん葉を除いた分球の部分をツエンケル氏液に24〜48時間固定し、同時間水洗いする。
(d)切片作成
上記固定品を用い、生長点を1/2葉序でとりまく相対する葉の中心を通る厚さ約10μの縦断切片を作成し、ツエンケル試液固定による後処理(0.5%ヨウ素、エタノール溶液、0.5%チオ硫酸ナトリウム水溶液で順次切片を洗浄する)ののち染色し、顕微鏡下で観察する。 (e)染 色
塩化亜鉛・ヨウ素試液、フロログルシン・塩酸、酢酸メチルグリーン溶液およびスダンIII溶液による膜質の試反応を行った。
複瓠・ 非照射品の発芽の時期および照射による組織変化の時期
┌───┬─────────┬─────────┬───────────┬───────────┐
│ 試 │ │ │ * │ ** │
│ │ 収 穫 日 │ 照 射 日 │ 非照射品の発芽 │ 照射による組織 │
│ 料 │ │ │ 開始の時期 │ 変化の時期 │
├───┼─────────┼─────────┼───────────┼───────────┤
│(イ)│1971.9. 6│1971.9.18│ 12月下旬 │ 11月中旬〜 │
│ │ │ │ │ │
│(ロ)│1971.8.24│1971.9. 6│ 11月中旬 │ 11月上旬 │
│ │ │ │ │ │
│(ハ)│1971.8.10│1971.8.20│10月下旬〜11月上旬│10月下旬〜11月下旬│
└───┴─────────┴─────────┴───────────┴───────────┘
(注) *:玉ねぎ球から0.5〜1cmの芽が開出したものを20kg入り1箱中数球以上認めた時期
**:玉ねぎ球を縦断し生長点付近の変化を黄色のzoneとして肉眼で認め得た時期
非照射品の発芽は適期前収穫の(ロ)(ハ)では(イ)に比べ早い。照射品の組織変化はいずれも照射後2カ月経過時に起こる。なお、本実験における照射品の発芽は(イ)が最も少ない。
(b)非照射品の生長点付近の試料
(イ)では収穫後初期の時点には、生長点は1/2葉序に並んだ。葉鞘部と葉身部の分化の明らかでない幼葉1〜2枚とその周囲を葉鞘部と葉身部の分化した幼葉(以上将来、球の外に開出する葉(約6〜8枚によっておおわれ、その外側は貯蔵組織として発達した多肉質のりん片葉で囲まれる[第(2)−1〜3図]。
収穫後約2週間した時点では、生長点は低い小丘状で1/2葉序にしたがって葉原基から分化する幼葉の発達が認められるにとどまる。しかしその後約2〜3カ月を経たいわゆる休眠終了(球から葉の開出)に先立ち、生長点周辺の幼葉は分球内で大きく伸長し、一方、生長点下部のごく若い茎の細胞は、並側分裂の結果、放射方向に膜が揃い、花茎として発達するきざしを見せる。
試料(ロ)(ハ)は上記類似の構造および変化を示すが、収穫後約2週間の時点では、生長点をとりまく幼葉数が少なく、それら幼葉はきわめて短い。
(c)照射品の組織変化
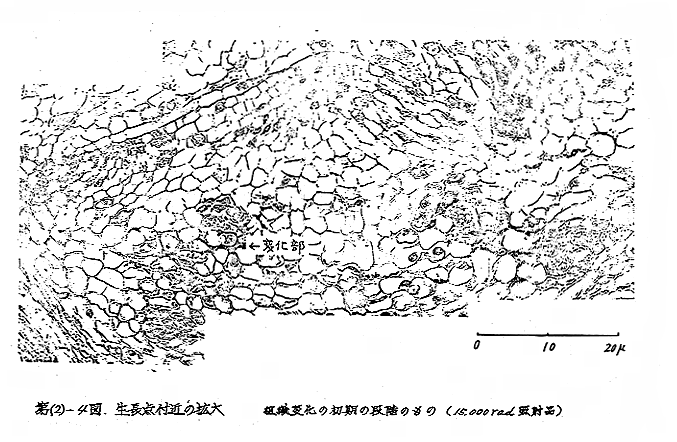
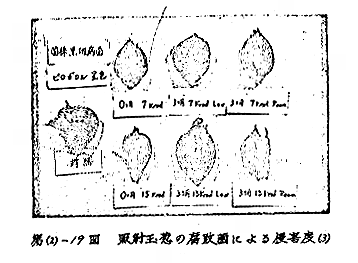
(c−1)変化の部位:試料および照射線量の違いに関係なく変化の部位および変化の時期はほぼ同じで、照射後約2カ月経過時に生長点やそれをおおう周辺の幼葉の基部を付着する部分(即間の短縮した茎)、内部に細胞膜質、細胞質の萎縮および変質した数細胞を認め、その後1〜2週間の間に急激に変化し、変質した細胞の範囲はひろがり、肉眼で観察しうる黄色のzoneになる。このzoneを形成する細胞の膜質は部分的に木化およびコルク化を示す。さらに経時にともない、このzoneの上部に位置する生長点を含む細胞にも木化、コルク化などの膜質の変化が現われる。[第(2)−3〜4図]
(c−2)変化の程度:試料(ロ)(ハ)では経時にともない茎の黄色のzoneは、褐色に変化しその上部の幼葉も褐色となり、玉ねぎ球を縦断したとき、分球中心部の褐変として目立つが、(イ)では7カ月経過時(4月中旬)でも黄色のzoneのままであり、この範囲は広がらず、また、zone上部の幼葉はおおむね白くみずみずしい。特に(イ)の15,000rad照射品では、zoneは薄層で玉ねぎ球を縦断したとき分球中心部の変化は目立たない。
いずれの試料でも7,000rad照射品より15,000rad照射品の方が、zone上部の幼葉の褐変の範囲および程度は少なく、葉の開出した照射品でも、一見正常に見えながら照射による影響を受け、生長点付近は上記と同様の変化を起こしていた。
上記の結果を総合すると、収穫適期前に収穫した場合には、照射後の組織褐変が著しいのに対して、適期収穫のものでは組織変化の範囲および程度が少なく、また適期収穫試料でも、休眠終了期に近づけば分球内の幼葉の伸長や花茎発達が始まることがわかる。そこで、発芽抑制効果と品質を保つ意味で適期に収穫した試料の休眠初期に照射処理を行なうことが、最も良好な結果を与えるものと組織学的に判断できる。
 |
 |
 |
前記1.−(1)の適期収穫2週間前の札幌黄を9月2日、適期収穫の札幌黄を9月16日に入手した。貯蔵は常温、常湿下で行ない、適宜分析に供した。発芽抑制効果を観察するため第(2)−1図に記した各時点で7kradと15kradを30krad/hで照射した。照射は大阪府立放射線中央研究所のCo−60γ線照射装置を用いて行なった。
下記の分析には、第(2)ー6図に示したような内芽を使用した。カロチノイドの色素は、Davisらの方法により抽出し、hexane区分の吸光度(440mμ)で表わした。アスコルビン酸は、ヒドラジン法によって測定した。また、メタリン酸抽出液中の還元性物質をSephadex−G10カラムを用い、展開液2%メタリン酸液で分離した結果、二つのピークを得た。標準のアスコルビン酸とグルタチオンを同条件下で分離した結果、そのうちの一つ(peak I)はグルタチオン、他の一つは(peak II)は、アスコルビン酸に相当したので、peak Iはグルタチオンとして、またpeak IIはアスコルビン酸として換算した。ただし、定量は、ヨウ素酸化法によった。
 |
本実験結果は第(2)−7図にまとめた。
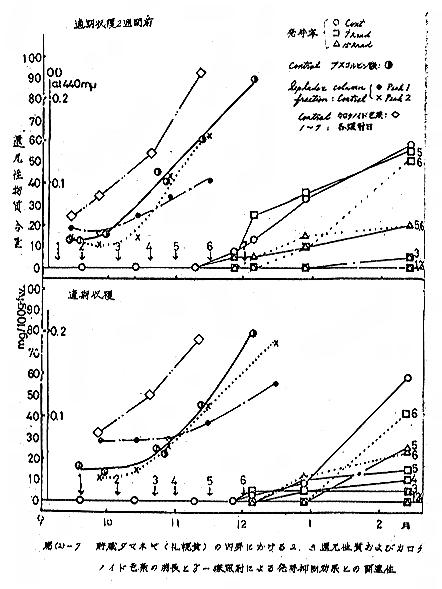 |
適期収穫2週間前のもの、適期収穫のものにおいても、貯蔵中急激に増加した。発芽抑制効果との関係をみると、実験開始時の含量の約2倍になったところに照射したものでは、図では照射日3、4に当たる頃、7kradと15krad(以下照射区と一括)とも貯蔵中若干発芽するものが認められるようになった。それ以後の照射では、明らかに発芽抑制効果は劣った。
両収穫時期のものにおいても、貯蔵初期の変動の少ない時期の後、急激に増加する。発芽抑制効果との関係をみると、アスコルビン酸含量が増加し始め、その含量が約30mg/100gfwに達する頃に照射したものでは、図では、3、4の照射日のもの、照射区で貯蔵中若干発芽するものが発生した。それ以後では照射による発芽抑制効果は明らかに劣った。
Peak I,peak II ともそれらの含量の増加傾向も、また発芽抑制効果との関係も、アスコルビン酸について得られた結果とほぼ同様であった。ただし、peak I はその傾向は、後にずれるようであった。
以上の結果から内芽における成分のうちとくにアスコルビン酸含量の消長とγ線照射による発芽抑制効果の低下との間に関連性を求めることが妥当と考えられた。すなわち、内芽のアスコルビン酸含量が30mg/100gfwに達したものでは、7kradおよび15kradの線量の照射では、その後の貯蔵中に発芽するものが発生することが認められ、内芽のアスコルビン酸含量の変動の少ない時期でその含量が約20mg/100gfw以下では、照射するとほぼ完全に発芽が抑制されることが期待できることがわかった。
前記 1.−(1)の札幌黄の収穫適期4週間前、2週間前、適期および適期2週間に収穫したものを試料とした。
ソモジ変法による糖の定量を行なったが、できる限り簡便な方法をということで種々検討し、予備実験の結果も勘案した結果、次の手順を採用した。
玉ねぎ5個から根と黄銅色の外皮を除き、ステンレス製包丁で細片としたなかから試料100gを取り、沸騰水約200ml中に加えて3分間煮沸を続けた後、ミキサーでホモジネートにする。晒し木綿で搾り出し、抽出液は定容フラスコを用いて500mlにする。そのうち100mlを取り、30%酢酸鉛溶液10mlを加えて除蛋白、過剰の鉛は3%シュウ酸ナトリウム溶液を加えて除去した後、定容フラスコを用いて100mlにする。そのうち、20mlを250mlに希釈し、この溶液をソモジ変法による還元糖の定量に用いた。別に20mlを取り、水100mlおよび5.5% シュウ酸溶液12mlを加え、沸騰湯浴中で25分間加水分解し、放冷後水を加えて250mlに希釈、ソモジ変法により糖の定量を行ない、全糖とした。玉ねぎ鱗茎の個体差を考慮して、さらに玉ねぎ5個より上記の手順を繰り返し、得られた定量値が大きくかけ離れた場合には、さらに定量を繰り返すこととした。
 |
 |
全糖および還元糖を定量した結果は第(2)−4表のようであった。表に示されるように、全糖については適期4週間前から適期にかけて殆ど変化はなく、適期以後はかえってわずかながら減少する傾向があるのに対して、一方、還元糖はわずかながら増加する傾向が見られた。いずれにせよ、玉ねぎ鱗茎の個体差を考慮に入れると、糖含量のみで適期を判断することはいささか困難である。
| 収穫時期 |
試 料(鱗茎5個) 重 量 (g) |
還 元 糖 (%) |
全 糖 (%) |
|||
| 1* |
2** |
1* |
2** |
1* |
2** |
|
| 4週間前 2週間前 適 期 2週間後 |
675 675 1000 1155 |
675 685 1105 1110 |
3.08 3.17 3.14 3.56 |
2.90 3.41 3.70 3.62 |
6.37 6.48 6.85 6.25 |
6.67 6.86 6.43 5.80 |
| 1*:1回目の測定 2*:2回目の測定 |
発芽抑制を目的として玉ねぎにガンマ線照射を行なったとき、品質と風味に関連して玉ねぎの諸成分や酵素活性が照射直後あるいはその後の貯蔵中にどのような影響を受けるかを知るため、下記の諸項目について分析あるいは測定を行い、また照射した玉ねぎが微生物汚染により腐敗し易くなるか否かの検討を行った。
適期収穫した泉州黄玉ねぎに20日後、7および15kradの照射を行い、以後室温に保存した。一部試料は収穫後室温および4℃に冷蔵し、3カ月後に照射を行い、以後室温で保存した。
照射直後および貯蔵中数カ月にわたる呼吸の変化を試料全体について行い、これと平行して収穫直後照射試料については組織切片による呼吸量の測定も行った。試料全体の呼吸はClypool and Keefer の方法による通気式呼吸測定法によって室温下で行ない、放出される炭酸ガスを30℃下でCO2吸収管(100ppm NaHCO3 を25ml、250ppm フェノールレッド 0.5mlを含む)で吸収させ、その際生ずる炭酸イオンの変動にもとずくフェノールレッドの色調の変化を、波長558mμで測定し、標準CO2で求めた検量線より炭酸ガス濃度を測定し、次式によってCO2mg/kg/hrとして算出した。
CO2mg/kg/hr
=(CO2%×F/100W)×(273/T)
×(P/760)×(44/22.4)
F:通気速度(ml/hr、本実験では6,000ml/hr)
T:試料室の絶対温度、
P:大気圧(mmHg)
W:試料重量(Kg)
組織切片の呼吸は底盤部とりん葉部に分け、ワールブルグ検圧計を用い常法により30℃下で測定した。組織切片の大きさは、底盤部については、5×5×1mmとし、りん葉部については幅10mm長方形のりん葉を作りこれをさらに厚さ1mmに切ったものとした。緩衝液は、1/10MKH2PO4をそのまま用いた。組織切片の呼吸量は酸素吸収量でもって表示した。
試料全体の呼吸に対する照射の影響は第(2)−5表および第(2)−6表に示す。
照射により試料の呼吸は数時間後に増大するが、その後は、急速に減少し、対照区に近づく。このような傾向は収穫当初照射したもの、3カ月貯蔵後照射したものについても同様であるが、照射の呼吸への影響は3カ月貯蔵したものにおいて、収穫当初のものより大きい。組織切片の呼吸は初のものについて経時的に測定したが、貯蔵中15krad区のりん葉部の呼吸が、対照区のそれに比較してやや大きい傾向が認められた以外は、試料全体の呼吸の傾向とほぼ同様であった[第(2)ー7表]。
| 線量(krad) |
照 射 直 後 の 時 間、 日 数 |
||||
| 2〜3時間 |
24〜26時間 |
30 |
70 |
130 |
|
| 対 照 区 7 15 |
6.7 mg/kg/h 7.9 13.0 |
8.8 8.1 9.9 |
8.6 9.5 9.7 |
6.3 8.3 10.0 |
7.9 4.7 3.9 |
| 測定温度 (℃) |
24.1 |
23.2 |
30.0 |
27.0 |
17.0 |
| 線量(krad) と 区 |
照 射 後 の 時 間 ・ 日 数 |
|||||
| 6〜8時間 |
18〜20時間 |
28〜30時間 |
70 |
130 |
||
| 室 温 貯 蔵 |
対 照 区 7 15 |
6.7 mg/kg/h 12.3 19.3 |
11.8 23.6 22.1 |
12.8 21.6 16.2 |
9.2 15.3 11.3 |
7.9 8.3 7.3 |
| 冷 蔵 |
対 照 区 7 15 |
20.0 41.0 38.1 |
26.6 32.1 30.3 |
22.2 23.8 19.0 |
14.9 19.3 13.3 |
5.5 5.2 7.7 |
| 測定温度 (℃) |
23.0 |
23.0 |
23.5 |
23.0 |
17.0 |
|
| 測 定 部 位 と 線 量(krad) |
7月8 〜 9日 |
8月7 〜 9日 |
9月28日〜 10月1日 |
|
| 底盤部 |
対 照 区 7 15 |
281.2μl/g/h 346.2 319.6 |
215.4 207.6 259.2 |
292.4 324.8 304.6 |
| りん葉部 |
対 照 区 7 15 |
19.9 20.6 26.1 |
15.9 16.3 22.3 |
19.5 10.5 28.1 |
| 収穫直後照射 |
上記 3.−(1)と同一試料を用いた。
玉ねぎの特徴である特有な味はAlkyl cysteine sulfoxideが酵素によって分解形成されるものとされている。この酵素(Acsolyaseと略す)の活性は生成するピルピン酸を定量して測定した。酵素液は、玉ねぎ5個をとり、各々そのディスクを除去したものを放射状に切った切片から均一にとって50gを試料とし、これに0.1Mリン酸緩衝液(pH6.8)50ml加えて100mlとした。この原液を反応直前に0.1Mリン酸緩衝液(pH8.0)で2倍に希釈して酵素液とした。
基質液(20μM/ml−n−propylcysteine sulfoxide)1ml、酵素液1ml、リン酸緩衝液(0.1M、pH 8.0) 2mlの組成の反応液を37℃20min 反応させた後、10%TCA 4mlを加えて反応を停止させた。別に基質液の代わりに水を用いた反応液を blanc test として同様に反応させた。
反応液をろ過して50mlとし、これより2mlとり2.4−ジニトロフェノール液(0.0125%)1mlを加え、37℃、10min反応させ、冷却後0.6N−NaOH5mlを加えてよく攪拌し420mμで比色した。
Acsolyaseの活性はピルピン酸mmole/20min/玉ねぎ100gで表示する。
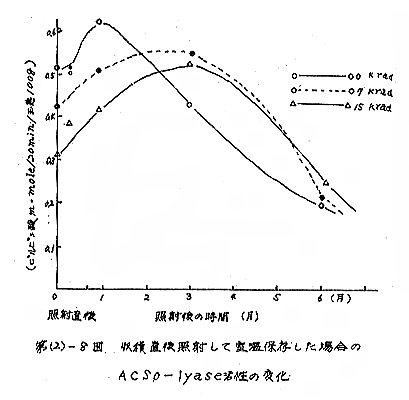
収穫直後照射した試料に関する結果は、第(2)−8図に示す。照射直後に本酵素活性を調べた結果非照射のものに対し、7krad照射では82%、15krad照射では58%に活性が低下した。
照射後室温に放置してAcsolyaseの活性を経時的に測定すると非照射のものは、最初の1カ月間に活性増加を示すが、後は漸減の傾向を示した。一方、7krad、15krad照射したものでは、照射によって低下した活性が回復し、3カ月で活性の最高を示し、後は減少した。照射したものの3カ月後の活性は実験開始時における非照射のものと同じレベルまで回復した。
収穫後、3カ月室温貯蔵した場合、照射により活性は収穫直後照射の場合と同様に低下し、後は漸減の傾向をとる。
しかし、7krad照射したもののみ照射後1カ月は、活性の回復が見られた[第(2)−9図]。3カ月後低温に保存した後、照射した場合も傾向はほとんど同じで、7krad照射したものの活性がみられる。
玉ねぎ特有の香味に対する放射線照射の影響については、その香味形成に関与する基質と酵素の両者に対する影響があると考えられる。酵素については、上記の結果から7および15krad の線量で照射直後には低下が見られた。これは収穫直後でも3カ月貯蔵した試料でも同様であった。このような酵素活性の低下が玉ねぎの香味にどの様に影響するかは、最終的には香味試験によらなければならないが、酵素活性については、照射直後は上記のように下がるが、照射後1カ月位でも活性の回復があり、また非照射の試料でも収穫後1カ月を頂点として貯蔵により、酵素活性が漸減することが見出されているので、7および15krad 程度の照射では非照射のものに比して実際上香味形成にあまり影響ないものと考えられる。
 |
 |
前記 3.−(1)と同一試料を用いた。
各試料区についてパネルによる官能検査、head space vapor のガスクロマトグラフィーによる揮発成分の測定を行なった。さらにブルカプタン(主として n−プロピルメルカプタン)を Ruheman’s purple−Hg 塩法により定量、カルボニルを 2.4ジニトロフェニルヒドラゾン法によって測定した。
それぞれの区分について発芽していない健全な玉ねぎの外皮を除去してスライスにし、ミキサーにかけて得られたジュースから20gを150mlの広口ビンにとり、訓練されていないパネル約20人に非照射のスタンダードと0、7、および15krad照射した玉ねぎについてスタンダードとの識別、においの強さの比較を行わせた。
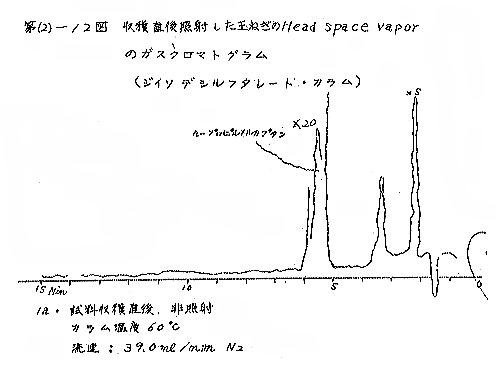
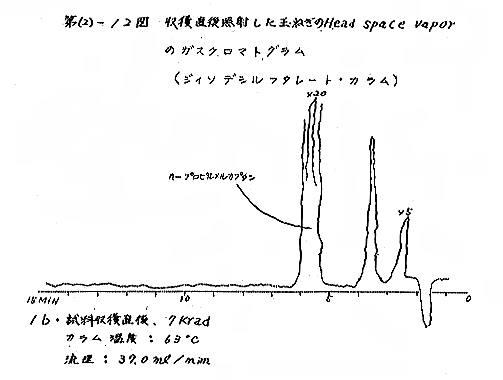
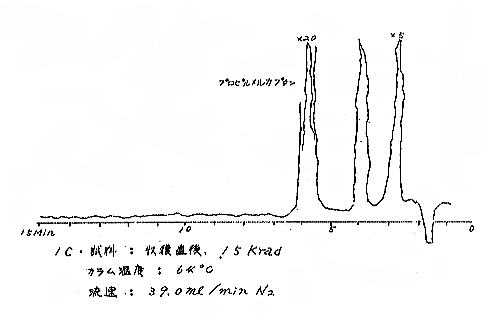
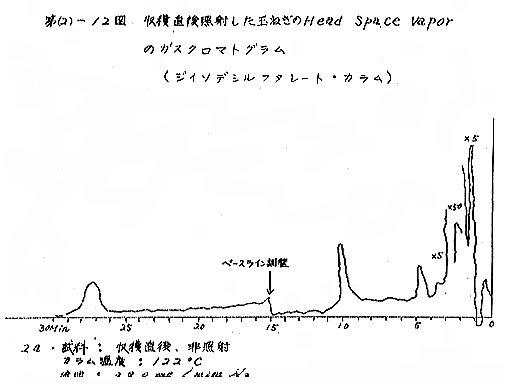
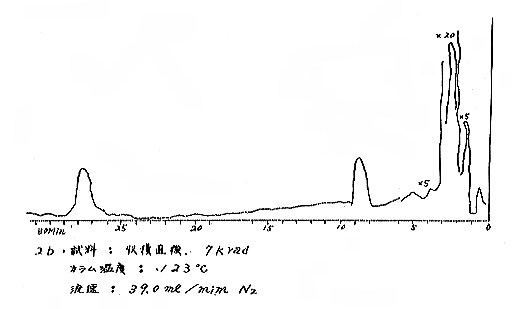
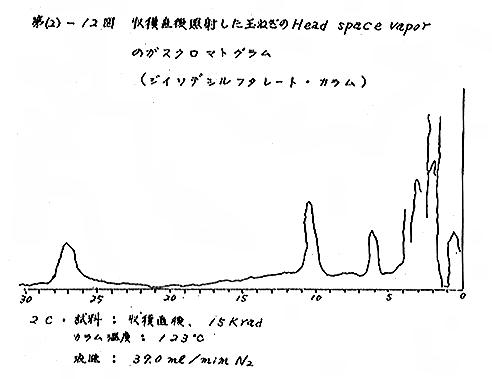
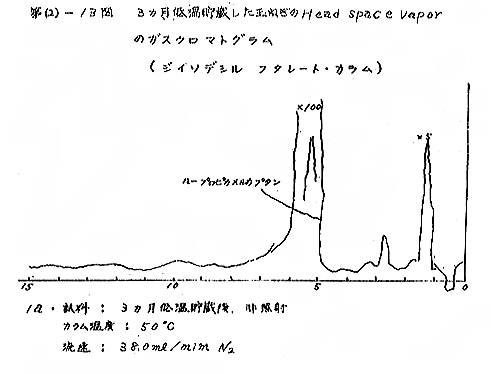
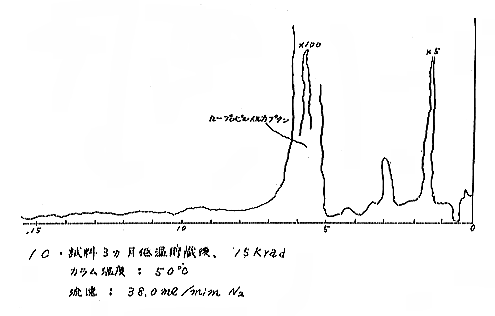
それぞれの試料について発芽していない健全な玉ねぎの外皮を除去して各部分が含まれるように楔形に約30gを切り取り、細片摩砕して100mlの三角フラスコにとり、栓をして室温に1〜2時間放置して得られる head space vapor のガスクロマトグラフィー(GLC)を行なった。Perkin−Elmer810(FID) ガスクロマトグラフ(理化学研究所)を使用し、カラムには Perkin−Elmer 標準カラム Diisodecyl phthalate(semi−polar)、Carbowax 1540(polar)、および Apiezon M(non−polar)の3種類を用いた。カラムのサイズはすべて1/8インチ×6フィート、カラムの温度は約50℃と約120℃。
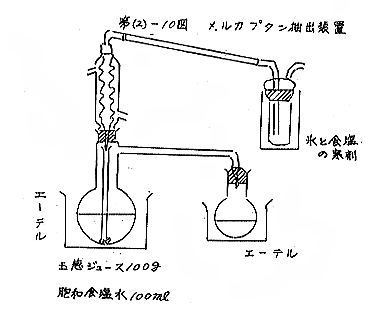
玉ねぎ2個から得られたジュースから100gをとり、100mlの飽和食塩水を加えて第(2)−10図に示す抽出装置を用い、エーテル(金属 Na を加えて蒸留精製)抽出を行なった。ジュースにしてエーテルを加えるまでの時間は約20分、抽出は6時間行なった。氷と食塩の寒剤で冷却したトラップには測定し得るほどのメルカプタンは検出されなかった。定量法はメルカプタンとHgの反応により遊離する Puheman’s purple を570mμの吸収を測定して求める方法である。
 |
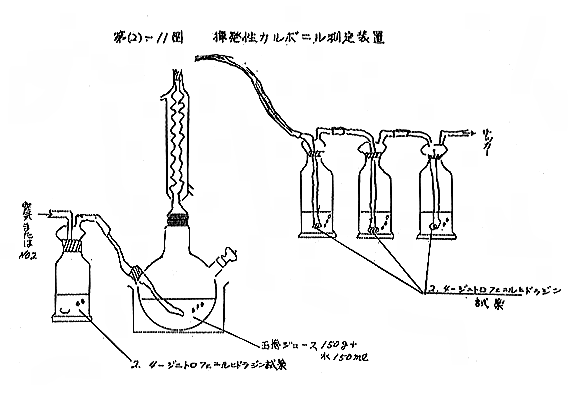
上記の方法により得られたジュース(玉ねぎ2個)から150gをとり、150mlの水を加えて第(2)−11図に示す装置を用い、室温または100℃で空気または N2を通じて発生する揮発性カルボニルを2.4−ジニトロフェニルヒドラジン塩酸溶液(2mg/ml ir2NHCl)のトラップに導き、生成したヒドラゾンの沈でんの量を測定し、また薄層クロマトグラフィー(TLC)によりカルボニルの同定を行なった。また不揮発性カルボニルについても定性的に検索を行なった。なお通気時間はすべて6時間とした。
 |
3カ月室温に貯蔵したものでは、約65%、低温貯蔵では、約7.5%が健全であった。
(a) パネルによる官能検査の結果は、パネルが馴れていないせいもあって、照射と非照射の試料の識別が悪かったが、識別できたパネルでは、線量が増すにつれて香気が弱くなることが認められた。
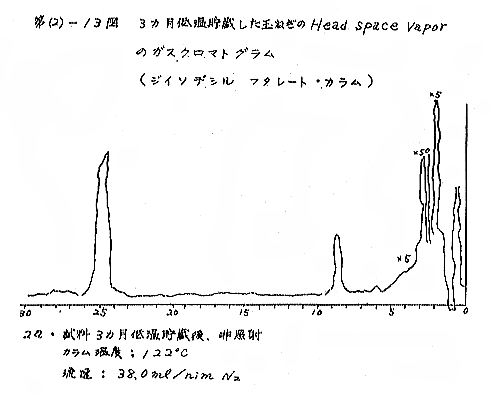
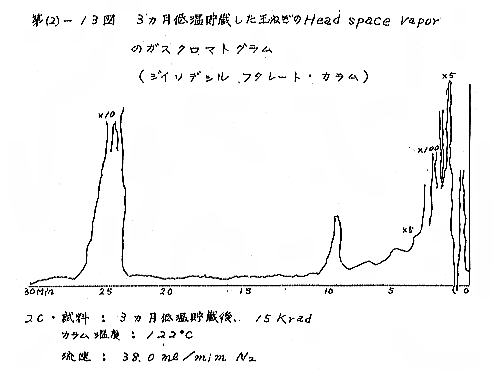
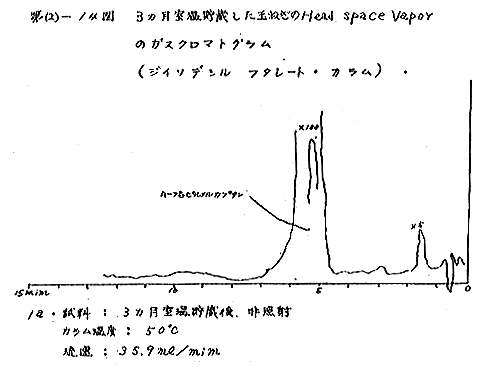
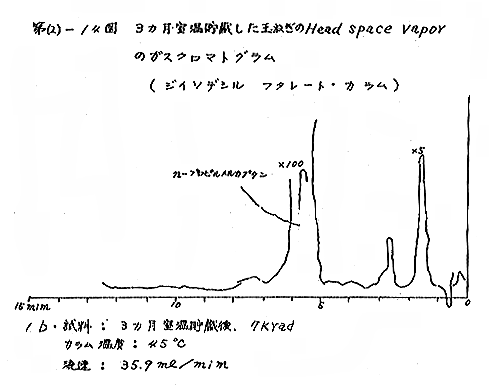
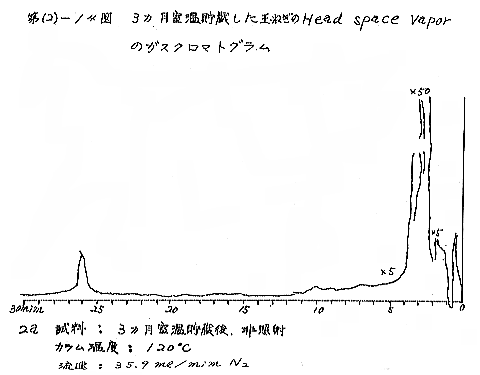
(b) Head space vapor の GLC の結果は、Diisodecyl phthalate カラムで分離したクロマトグラムを例として第(2)−12〜14図に示すが、7および15kradの照射ではいずれも非照射のものとの間に定性的な差があるようには見えない。3カ月低温貯蔵と室温貯蔵の試料区分の間には定性的にも差があるように見えるが、なお検討の余地がある。
(c) メルカプタンの定量の結果は第(2)−8表に示すが、照射線量を増やしてもはっきりした差は見られず、室温に長期間貯蔵すると減少するが、低温貯蔵ではかえって増加し、室温貯蔵のものでも秋になって気温が低くなるにつれて増加する傾向が見られた。
(d) カルボニル測定の結果は第(2)−9表に示すが、照射線量を増してもはっきりした差は見られなかった。なお揮発性カルボニルの2.4−ジニトロフェニルヒドラゾンのTLCならびにa−ケトグルタール酸との反応により再生されたカルボニルのGLCの結果、揮発性カルボニルの主要なものはプロパナールとアセトアルデヒドであった。前者の量が最も多い。他にTLCのクロマトグラムではさらに3〜5個のスポットが認められた。また留出残液からピルビン酸が検出された。
| |
照 射 直 後 |
室温2カ月後 |
低温2カ月後 |
| mg/kg |
mg/kg |
mg/kg |
|
| 収穫直後照射 0 krad 7 〃 15 〃 |
17.9:24.0 17.5:24.0 19.0:16.0 |
20.1 9.3 12.6:13.2 |
38.0 36.8 49.4 |
| 3カ月低温貯蔵後照射 0 krad 7 〃 15 〃 |
27.2:20.5 23.9 30.3 |
|
|
| 3カ月室温貯蔵後照射 0 krad 7 〃 15 〃 |
31.0:18.1 20.5 37.2:19.8 |
|
|
| (n−プロピルメルカプタンとして計算) |
| |
室 温 |
100 ℃ |
| mg/kg |
mg/kg |
|
| 収穫直後照射 0 krad 7 〃 15 〃 |
170.5 168.8 262.6 |
345.7 351.1 273.4 |
| 3カ月低温貯蔵後照射 0 krad 7 〃 15 〃 |
310.9 529.3 561.6 |
987.3 1068.7 904.5 |
| 3カ月室温貯蔵後照射 0 krad 7 〃 15 〃 |
269.3 557.4 613.7 |
1000.4 914.6 1070.7 |
| (2.4−ジニトロフェニルヒドラゾンとして測定) |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
前記 3.−(1)と同一試料を用いた。
ポリフェノールオキシダーゼの活性は、玉ねぎ5個をとりディスクを除いた後放射状に切断したものから均一に50gをとり、これを細切りにし、50mlのphosphate bufferを加えて低温でホモジナイザーにて1分30秒処理し、三枚重ねのガーゼでこした液に buffer を加えて100mlにしたものを酵素液とした。また別の実験では玉ねぎ10gをアセトン粉末とし、これに0.05M phosphate buffer(pH.7.3) 15ml を加え低温で遠心分離した上澄みを酵素液とした。活性はコーヒー酸を基質として酵素電極法によって測定した。
ポリフェノールオキシダーゼの活性は非照射試料とも極めて弱く、照射の効果を判定することは不可能であり、収穫直後および3カ月室温貯蔵後、照射のいずれにおいても同様であった。このことは、少なくとも照射により酵素活性が著しく強まることはない事実も示している。なお、酵素液基質の調整法を変えても効果の判定は不可能であった。
北海道産札幌黄に7kradの照射を行いその後室温で3カ月間貯蔵して、照射直後および貯蔵後の試料を非照射試料とともに分析試料とした。
発芽や腐敗していないものについて、褐色化した表皮と根を除き、10コづつの3区分に分けた。1区分について3回の定量を行なう。従って、1試料について9回の定量を行なうこととなった。この9回の総加平均を定量値とした。この場合の統計処理による標準誤差は2%以下であった。
玉ねぎの可食部を小さく切り、等量の水と共にミキサーで均質化させる。そのホモジネート20gに300mgのCaCO3と99%EtOHを60ml加えて1時間加熱還流させて糖の抽出を行い、ろ別した。残渣を更に1回76%EtOHで抽出し、抽出液をあわせてその一部を還元糖の定量に供し、残りは塩酸で24時間室温で加水分解し、全糖の定量に供した。[第(2)−15図]
糖の定量は、Somogyi−Nelson の比色法によって Glucose 換算量として定量した。
Glucose,Sucroseを用いて、調整および定量の全操作を行なった結果、それぞれの回収率はGlucoseは98〜100%、Sucroseは97〜99%であった。
 |
第(2)−10表のように全糖は照射と非照射には大差は見られない。また貯蔵中の変化も殆どない。照射直後の還元糖量は非照射試料に比較して少ないが、3カ月貯蔵後には逆に増加した。然し、その差は有意さとはいえないほどの僅かの差である。なお、糖のペーパークロマトグラムは照射・非照射試料に差を示さなかった。
|
(Glucose g/onion 100g) |
| 糖 類 |
貯 蔵 期 間 |
線 量(krad) |
|
| 0 |
7 |
||
| 全 糖 |
0 (月) |
4.96 |
4.95 |
| 3 |
4.84 |
4.98 |
|
| 還元糖 |
0 |
2.33 |
2.14 |
| 3 |
3.47 |
3.64 |
|
上記 3.−(5)と同一試料を用いた。
照射直後および3カ月貯蔵したもの、およびそれぞれの対照のビタミンCの定量を行ない、照射効果を調べた。ビタミンCの定量法には2.4ージニトロフェニルヒドラジン法を使用し、酸化型と総ビタミンCとを直接定量し、還元型ビタミンCは計算により求めた。実験は6回反復し、平均値とその標準偏差を求めた。
7krad照射直後の還元型Cの価は非照射の収穫直後に比べやや小さいが、直接定量した酸化型で3〜7%、総ビタミンCで10%以上の誤差があるので、計算で求めた還元型ビタミンCの価にもこれらが含まれる。従って両者の価の間には大差はなく、照射の影響はないと考えられる。同様に7krad照射し、3カ月貯蔵したものにも照射の影響はないと考えられる。
然し、非照射の収穫直後と3カ月貯蔵を比較すると、3カ月貯蔵で還元型が減少し、酸化型が増加する傾向がある。
照射試料も同様な傾向を示すので、照射の影響よりも貯蔵の影響の方が大きいと考えられる。
| 試 料 |
還元型 |
酸 化 型 |
総ビタミンC |
| 非照射収穫直後 7krad照射直後 |
4.3 3.6 |
2.6±0.3 2.6±0.4 |
6.9±0.2 6.2±0.4 |
| 非照射3カ月貯蔵 7krad照射直後 |
2.9 2.9 |
4.3±0.3 4.1±0.3 |
7.2±0.7 7.0±0.3 |
| (±は標準偏差を示す) |
前項同様 3.−(5) と同一試料を用いた。
試料玉ねぎ10コをとり、その各々の外皮およびディスクを除去し、均一に組織を切り150gを100mlの水とともに2分間ブレンダーで磨砕し、ガーゼで濾過後全量を500mlとした。これを10・E(4)rpm、15分間遠心分離し、上澄液を濾過助剤を用いて吸引濾過した。このうち200mlをとり、Amberlite 1R−120H 型に吸着させ、水洗後3NHCl 250mlで溶出、最初の250mlをとり、この溶出液中の全窒素量をβーナフトキノンスルフォン酸による比色法で定量した。
この塩酸溶出液20mlをとり減圧乾固し、このものについて、Beckman 式アミノ酸自動分析機を用いて、遊離アミノ酸の分析を行なった。
各試料中の全窒素およびアミノ態窒素量は次の通りである。
試 料 I(照射直後)
全窒素mg/ アミノ態窒素mg/
玉ねぎ100g 玉ねぎ100g
非 照 射 103.0 74.0
7krad
照 射 95.5 66.4
試 料 II(照射後室温に3カ月貯蔵)
全窒素mg/ アミノ態窒素mg/
玉ねぎ100g 玉ねぎ100g
非 照 射 102.5 56.3
7krad
照 射 102.3 59.8
次に遊離アミノ酸量は、第(2)−12表に示した。ただし各アミノ酸量は玉ねぎ100g中のmg数で示した。
これをみてわかるように照射直後のもの、照射後室温に貯蔵したものについても照射・非照射の試料の間で顕著な差は認められなかった。
| |
照 射 直 後 |
照射後室温で3カ月貯蔵 |
||
| 非 照 射 |
7krad照射 |
非 照 射 |
7krad照射 |
|
| Triyptophan Lysine Histidine Ammonia Arginine Aspartic Acid Threonine Serine Glutamic Acid Proline Glycine Alanine Cystine Valine Methionine Iso−leucine Leucine Tyrosine Phenylalanine |
19.10 7.32 56.12 24.45 10.02 31.32 143.15 1.50 1.75 4.27 0.60 6.25 0.47 4.30 13.77 9.75 4.27 |
16.26 7.30 65.90 23.22 7.52 26.05 138.10 2.27 1.22 2.92 0.77 4.80 0.32 3.02 11.47 7.97 4.12 |
17.88 8.02 10.24 61.48 27.51 9.06 32.67 155.87 4.34 1.60 4.21 0.50 4.47 0.64 2.83 9.52 8.44 5.08 |
17.51 9.18 10.68 64.82 26.23 9.01 40.37 144.99 4.50 1.74 3.12 0.61 5.96 0.57 3.98 13.57 9.89 7.62 |
前項同様、3.−(5)と同一試料を用いた。
それぞれ照射直後を照射後3カ月間室温貯蔵したものを外側と内側とに分けて生菌数測定用試料とした。
各区とも20個宛の玉ねぎからの試料を Tween80 の0.005%溶液1lを加えて振盪し、その上澄液を加熱(80℃15分間)したものと、加熱しないものとに分けて生菌数ブイヨンおよび麹エキスの2種の培地を用いて測定し、試料1g当りの生菌数を求めた。
また、放射線感受性の測定のため、玉ねぎに付着している微生物の分離は寒天培地上に形成される単一コロニーについて3回行ない、リン酸緩衝液中でCo−60γ線により照射して生存曲線をもとめた。
7krad照射したものおよび非照射の対照について生菌数を測定した結果を第(2)−13表に示す。
予備実験の結果によれば、約10倍程度の生菌数値のバラツキは誤差範囲以内と考えられるので、測定菌液を加熱しない場合および加熱した場合ともに7krad 照射による生菌数の変化は認められない。
照射直後の試料について7krad照射による生菌数の明らかな減少が認められないことは、実用上玉ねぎの発芽防止線量では殺菌効果は期待し得ないものと解される。また同様の傾向が照射後3カ月間貯蔵したものにも認められることは、照射した玉ねぎにとくに微生物が繁殖し易いとはいえないことを意味するものと思われる。
| 線 量 |
照射後 貯 蔵 期 間 |
照 射 直 後 |
照 射 後 3 カ 月 貯 蔵 |
||
| 測 定 培 地 |
肉エキスペプトン 培 地 (cells/g) |
こうじ 培 地 (cells/g) |
肉エキスペプトン 培 地 (cells/g) |
こうじ 培 地 (cells/g) |
|
| 7 krad |
外 側 |
4.9×10・E(6) |
2.1×10・E(6) |
2.9×10・E(5) |
1.5×10・E(5) |
| 内 側 |
1.6×10・E(4) |
1.7×10・E(3) |
1.6×10・E(3) |
2.2×10・E(3) |
|
| 非照射対照区 |
外 側 |
1.1×10・E(6) |
1.0×10・E(6) |
3.9×10・E(5) |
1.8×10・E(5) |
| 内 側 |
7.4×10・E(4) |
1.6×10・E(4) |
2.3×10・E(4) |
1.3×10・E(3) |
|
| 線 量 |
照射後 貯 蔵 期 間 |
照 射 直 後 |
照 射 後 3 カ 月 貯 蔵 |
||
| 測 定 培 地 |
肉エキスペプトン 培 地 (cells/g) |
こうじ 培 地 (cells/g) |
肉エキスペプトン 培 地 (cells/g) |
こうじ 培 地 (cells/g) |
|
| 7 krad |
外 側 |
2.8×10・E(2) |
1.8×10 |
7.2×10・E(2) |
7.1×10・E(2) |
| 内 側 |
2.3×10 |
1.3 |
8.0 |
5.0 |
|
| 非照射対照区 |
外 側 |
1.6×10・E(3) |
2.7×10 |
1.2×10・E(3) |
3.9×10・E(2) |
| 内 側 |
2.2×10 |
0 |
4.2×10 |
4.9 |
|
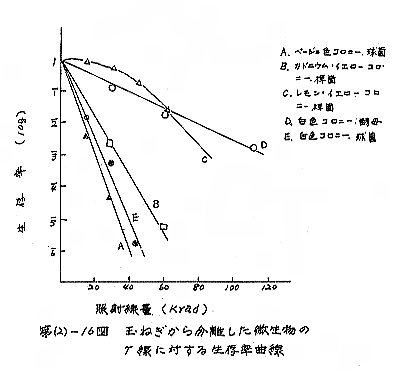
玉ねぎ試料のミクロフロラについて主要な微生物を分離して、そのγ線に対する生存曲線を求めると第(2)−16図の如くなる。それより求めた LD10 値を第(2)−15表に示す。
これによれば、γ線に対する感受性の高い菌では7krad の線量で生存菌数が1/10になるが、それより抵抗性の大きな菌が多いので、7kradの線量では全体の菌数が大きく変化しないことが理解される。
| 微 生 物 |
LD10(krad) |
| A(ベージュ色コロニー、球菌) B(カドニウムイエローコロニー、桿菌) C(レモンイエローコロニー、桿菌) D(白色コロニー、酵母) E(白色コロニー、球菌) |
7 12 47 49 8 |
 |
収穫直後の泉州中高を室温および低温(5℃)に貯蔵した。一部はただちに 7および15kradのγ線照射を行ない、以後室温に放置した。貯蔵中の試料は3・5カ月後に7および15kradの照射を行なった。
供試玉ねぎは外皮を除き水洗した後縦に4つ割とし、それぞれ一方の切断面に細菌または糸状菌芽胞の懸濁液を殺菌ガーゼを用いて塗布し、他の一方は塗布せず対照とした。塗布後の試料はガーゼを敷いた深型シャーレ内に1個ずついれ、さらに蓋内面にろ紙を置いて、27〜30℃に静置し、殺菌水をガーゼとろ紙に含ませてシャーレ内の湿度を飽和状態に保たせた。以後、連日観察を行なうとともに4〜6日後に侵害度の測定を行なった。
玉ねぎを汚染、侵害する可能性のある次の7菌株について感染試験を行なった。
菌 名 出 所
i Botrytis sp 農業技術研究所より分与
ii Ceratocystis
fimbriata 名古屋大学より分与
Ell & Halst
黒班病菌
iii Aspergillus 理化学研究所にて玉ねぎ
niger より分離
iv T−No.1(球菌) 同 上
iv T−No.2(桿菌) 同 上
vi T−No.3(球菌) 同 上
vii T−No.6(球菌) 同 上
上記のうち、細菌および黒班病菌は、馬鈴薯汁加蔗糖培養したものを Botrysis および Aspergillus は同じ培地の寒天斜面上に生育させ、その分生芽胞をリン酸緩衝液に懸濁したものを感染試験の種菌とした。
感染試験中の試料は肉眼的に切断面の軟化、変色の程度および微生物の生育状況を検査し、記録するとともに、パーオキシダーゼ作用を測定、比較した。すなわち、試料の微生物塗布面、非塗布面に先ず、2%過酸化水素水を、次いで2%ピロガロル水溶液、または1%ベンチジンの50%エタノール溶液を、ガーゼ片を用いて注意深く塗布し、それぞれ黄褐色または青黒色の呈色が発見されるまでの時間を測定し、また最大呈色の度合を観察、かつ、カラー写真に記録した。
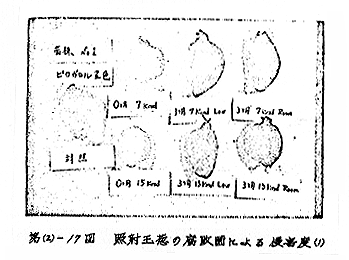
3カ月貯蔵の前後とも、本実験条件では黒班病菌、T−No.1菌およびTNo.6菌の3株のみが非照射玉ねぎの切断面に軟化、変化を生じ、菌の侵害を示すが、他の菌株ではほとんど侵害が見られない。7krad、15krad照射試料についても、前記3株菌のみが侵害し、何らの相違も見られない。従って元来感染し難い菌がγ線によって侵害し易くなることはないと結論される。
前記3菌株を用いて感染試験を行なった結果、対照切断面ではピロガロル呈色度の場合2〜3分間で、ベンチジン呈色の場合1〜1.5分間で発色が最大となった。菌塗布面では発色時間がやや遅れるほか、呈色の度合が少なく、明らかに淡い色を示す。
しかしながら、対照との間に見られる呈色上の差は、試料玉ねぎの貯蔵の有無、貯蔵温度ならびにγ線照射の有無、その線量によらずほとんど一様であって、明瞭な区別はつけ難い[第(2)−16図]。
肉眼的観察も同様な結果を示し、少なくとも15krad照射程度では、玉ねぎの微生物に対する感染性はほとんど影響されていないものと判断される。
 |
 |
 |
 |
食品に対する放射線照射において困難の大きい問題の一つは線量測定の問題である。元来、線量測定方法そのものに、原理的に各種の物理的、化学的方法があって、相互間の測定値が必ずしも一致しない。その上に食品照射の特質上、試料の形態、包装、線量率などが異なるので常に望ましい線量測定方法が利用できるとは限らない。また大量の試料の照射を行なうときには、照射効果を均一化せしめるため、実際に試料各部の吸収線量を正確に測定せねばならない。そこで実際に個々の玉ねぎおよび包装箱に入れた状態でガンマ線照射を行ない、各種線量測定方法の比較、玉ねぎによる吸収の程度ならびにバルク包装での線量分布などを検討した。
名古屋大学設置のCo−60ガンマー線照射装置(線源 Co−60 4,000Ci)を使用した。
線源より50cmおよび200cmの円周上試料台上10、15cmに線量計を並べ、その間の線量と、その前に玉ねぎを切断し、厚さ5、10、20cmの層としたもの、水の筒を同じ厚さとしたもの及び玉ねぎを丸のまま2個、4個並べた場合の線量の変化を調べた。
(a)ガラス線量計(東芝蛍光ガラス、ピース8×4.7mm
及び針1mmφ×6mm)
(b)鉄線量計(Fricke)
(c)電離槽型線量計(Victreen社 Radcon)
ガラスは名大農学部設計改造による蛍光線量計及び東芝蛍光線量計による蛍光光度測定と吸収光(400mkμ)の光度測定を行なった。
まず、Radcon線量計とFricke鉄線量計を比較したところ良く一致するので、これで得られた線量を標準にして、ガラス線量計の信頼度、玉ねぎ試料による線量吸収の度を測った。
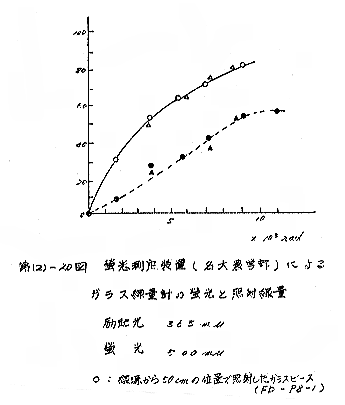
(a) 東芝蛍光ガラスの蛍光光度と線量との関係は、名大農学部式で測定した場合、ピースでは放射線状となり、針では8,000R付近まで直線を示した。また、線源より50cmと200cm の所で照射したもので線量率の差は認められなかった。[第(2)−20図]
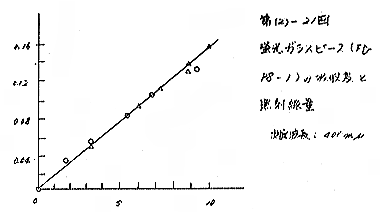
(b) 同じガラスのピース型のものを用い、400mμの吸光度と線量との関係を求めた結果10,000Rまで直線を示し、線量率の差もなく、結果はよく一致した。[第(2)−21図]
(c) 東芝ガラス線量計用測定器を用いて蛍光光度と照射線量の関係を調べたが、線量率による差異がみられ、また、ピース、針もそれぞれ2000R、3000R付近までしか直線がえられず、結果の振れがかなり大きかった。
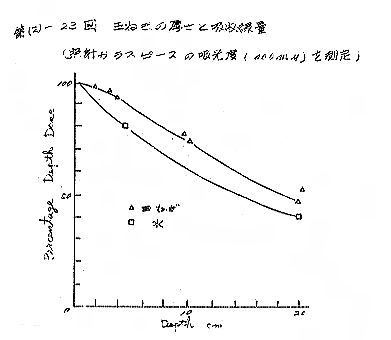
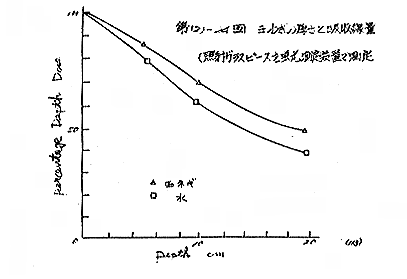
(d) これらの結果から、最も信頼のおけるa、b式でのガラス線量計及びFricke 線量計を用いて第(2)−22図のように、玉ねぎを前においた場合の低下を調べると(線量計600R/hr)、次のように線量が低下した。
玉ねぎ 厚 さ 10cm 69%
〃 〃 20cm 50%
〃 そのまま 2 個 65%
〃 〃 4 個 40%
この低下率は、同じ厚さの水の層に比べると低下の程度はやや少なかった。水の場合は、10cmで5.9%、20cmで34.5%となる。[第(2)−23〜24図]
 |
 |
 |
 |
 |
前項4.−(1)と同じ装置
試料をダンボール箱に入れ、包装箱内の線量分布を調べ、また、試料を5、10、20、40cm等の厚さに水平に並べ、試料の吸収線量を、そのまま及び回転しつつ測定した。
また、包装材料としては、板、ポリエチレン、段ボールを用い、吸収線量を測定比較した。
線量測定は、鉄及びセリウムの化学線量計とガラス線量計(東芝及びポシュロム)を比較検討した。
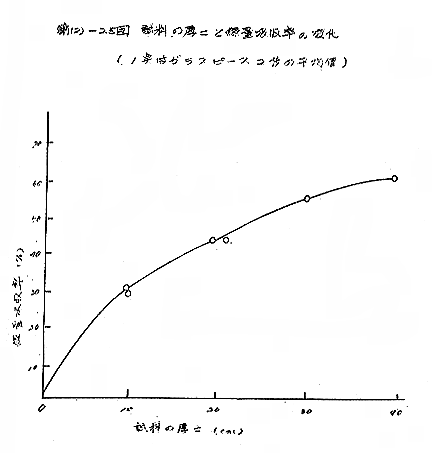
試料の吸収線量は前項の試験と同じ結果を得た。[第(2)−25図]
バルク包装における試料の分布状態をガラス線量計で検討した結果、照射処理に差し支えない程度に均一で問題にする必要がないことが分かった。また、板、プラスチックフィルム、段ボールなど包装材料の影響も線量測定の上で傷害にならないことが分かった。[第(2)−16〜18表]
以上、玉ねぎの発芽抑制を目的とするγ線処理の実用化の基礎研究として、主にガラス線量計、Fricke鉄線量計を中心に測定法の検討、試料の吸収線量の実測について試験研究を行なった。
この結果については発芽防止処理のための 1×10・E(4)R 前後の照射の線量測定としては、ガラスの蛍光で測定することは標準曲線で得られないために不正確になる。ガラス針を用い改造型の蛍光のガラスは一定に保持しにくい点や、端が破損し易い欠点があり、この点について針のためのホルグーを改造する必要がある。ガラスピースは400mμの吸収で測定する場合測定しやすくまた再現性も良く大体満足すべき結果を与えた。
しかしこれらの線量用ガラスは、いずれも高価なことと退色現象があることなどが欠点である。
したがって、透過光の吸収で測るに適した安定性、再現性のある且安価なガラス又はプラスチックの開発が望ましい。
|
A:被照射線量(×10・E(4)R/30分) B:照射台上5〜20cm間の平均空間線量[3.7×10・E(4)R/30分]に対する線量減少率(%) C: 〃 〃 〃 線量吸収率(%) |
| |
A |
B |
C |
| 各測定地点における線量 |
2.15 2.00 1.60 1.75 1.75 1.75 2.15 1.75 2.00 |
58.1 54.0 43.3 47.3 41.9 47.3 58.1 47.3 54.0 |
41.9 46.0 56.7 52.7 58.1 52.7 41.9 52.7 46.0 |
| 平均線量 1.91 Bulk 包装による平均線量の 減少率(平均線量吸収率)(%) モデル実験による線量吸収率(%) |
1.26 |
50.3 |
(49.7) 58.0 (厚さ29cm) |
| |
A |
B |
C |
D |
E |
| 被線量[×10・E(3)R/2分] 回転*した場合の被線量[×10・E(3)R/2分] |
10.8 6.0 |
7.6 5.9 |
5.3 5.2** (86.0%) |
5.0 6.0 |
4.0 6.1 |
| *: 回転回数 20回転/分 **: A+E/2線量に対する% |
| 包 装 材 料 |
空間線量 |
板 |
ダンボール |
ポリエチレンフィルム |
| 被線量[×10・E(3)R/9分] 線量吸収率 (%) (空間線量に対する) 各材料単位当りの線量吸収率(%) |
4.20 |
3.56 15.0 3.0 |
3.66 12.8 1.3 |
3.90 7.2 0.03 |
| (注) 板: 5枚重(1枚の厚さ 92mm) ダンボール10枚重(1枚の厚さ 5mm) ポリエチレンフィルム266枚量(1枚の厚さ 0.05mm) 各数値は蛍光ガラスRods2本の平均値 |
 |