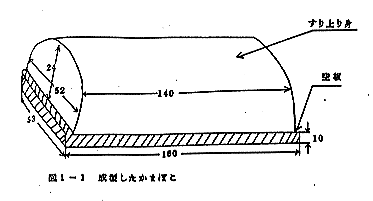
図1-1 成型したかまぼこ
 |
日本水産株式会社所属の峰島丸が北洋で製造した特級スケソータラ無塩冷凍すりみ(砂糖 4.0%、ソルビット 4.0%、タリンサン 0.2%含有)を主原料として用いた。〔注:タリンサン(商標)はポリリン酸ナトリウム50%、ピロリン酸ナトリウム(無水)50%の混合物〕
かまぼこ製造には次の配合割合を採用した。
配合割合
冷凍すりみに対して
食 塩 2.7%
ジャガイモ澱粉 5.0%
グルタミン酸ナトリウム 1.0%
砂 糖 1.0%
卵 白 8.0%
W P 0.05%
みりん 2.0%
〔注:WP(商標)はイノシン酸ナトリウム50%、
グアニル酸ナトリウム50%の混合物〕
冷凍すりみをスリミカッターで細断し、すりみ温度0℃まで室温で解凍する。これを擂潰機に投入し、配合割合にしたがい順次添加して35~40分間擂潰する。すり上り温度は12℃。
擂潰終了後、空板(材質:エゾ松)にすり上り身を175g,手付により、図1-1のように成型した。
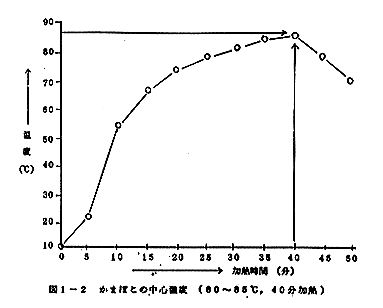
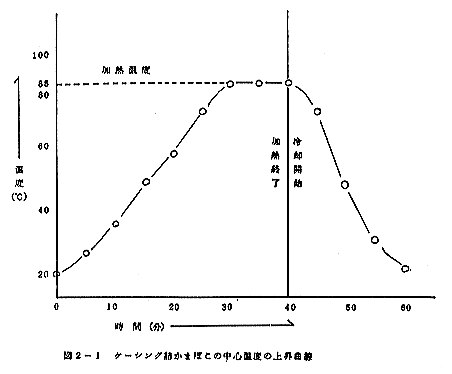
成型したものを、セイロにより80~85℃(蒸気)で40分間加熱後、水道水で蒸し上りかまぼこの表面を5秒間洗う。これを室温で60分間放冷した。この際のかまぼこ中心温度の上昇曲線は図1-2に示す通りであった。
冷却したかまぼこを防湿セロハン(トーセロ東京セロハン紙株式会社品種MST-34A番手#300 製造番号18165411T.T)で全面を包装して底部及び小口面(かまぼこの断面図)でヒートシール密封した。
包装したかまぼこを東海区水産研究所保蔵部において300kradのガンマ線照射を行ない、照射したかまぼこは非照射かまぼことともに室温および5℃で貯蔵し、室温貯蔵の場合は照射直後、3日後、5日後に。5℃貯蔵の場合は照射直後、1週間後、2週間後、1ヶ月後にそれぞれ測定を行なった。
 |
 |
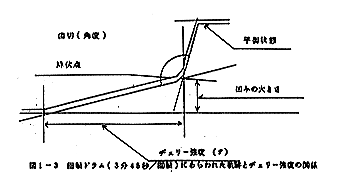
岡田式ヂェリー強度試験器を使用して、ヂェリー強度、凹みの大きさおよび歯切を測定した。
直径5mmのブランヂャー先端を試験かまぼこ片に接触させておき、一定流量の水をブランヂャーに荷重していくとブランヂャーは試験片中に押し込まれていき、ついには降伏点に達する。
これに要した水の重量を”ヂェリー強度(g)”、押し込まれた深さを”凹みの大きさ(mm)”(回転ドラムに軌跡をあらわす関係上3.7倍の増幅値となる)、降伏点に達してから平衡状態にもどるまでの時間を”歯切(角度)”とする。この関係は図1-3に示される。
ヂェリー強度の数値は大きいほどよく、凹みの大きさの数値は大きいほどよく、また歯切は数値の小さいほどよい。
 |
弾性(足)の官能検査は、蒲鉾研究所員のパネル5名で次の10点法により行なった。
1点: 足がない
2点: 足がない
3点: わずかに足が感じられる
4点: わずかに足が感じられる
5点: やゝ足が感じられる
6点: 足がやゝ劣るかまぼこ
7点: 足が普通のかまぼこ
8点: 足がよいかまぼこ
9点: 足が非常によいかまぼこ
10点: 足が非常によいかまぼこ
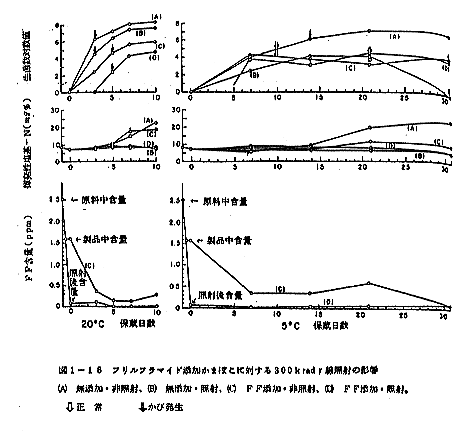
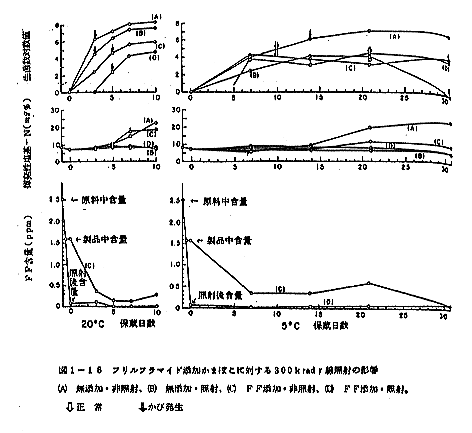
300kradの照射処理を行なったかまぼこを室温(20~26℃)および5℃に貯蔵した際のヂェリー強度、凹みの大きさ、歯切および官能検査上の変化を表1-1と表1-2に示す。
照射直後の測定結果を比較すると、照射試料は非照射試料に対してヂェリー強度で70gの、凹みの大きさで2mmの増加を示し、また歯切れでは 4゜の減少を示しており、幾分か品質はよい方に傾くがその差は小さく、官能検査においては(表1-1)両者とも8.0点で差は感じられなかった。
しかし、この差は3日、5日と貯蔵期間が進むにつれて大きくなり、5日間貯蔵後の非照射試料はヂェリー強度で140g,凹みの大きさで5mm大きく、歯切で8゜小さくなり、明らかに優れた弾性を示す。官能検査の結果もまた非照射試料の6.5点に対して照射試料は8点と相当な差が認められる。このように照射試料と非照射試料とで差の拡大する理由は、非照射試料のヂェリー強度、凹みの大きさ、歯切で表わされる弾性が貯蔵につれて急速に低下するためで、一方照射試料の弾性は5日間を通じて殆ど同じ状態を保っているためであろう。
全く同様な傾向は5℃貯蔵でもみられる。照射直後に見られた弾性の差は1ヶ月後に更に拡大し、照射試料のヂェリー強度は260g,凹みの大きさは7mmと大きく、歯切の角度は4゜小さい結果となって、官能検査によっても非照射試料の7.0点に対し8.0点と照射前と変わらない値が得られる。
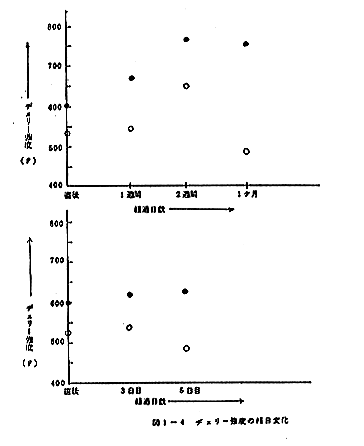
弾性向上はそのまま品質向上ともいえるものであるから、換言すれば室温貯蔵をしたとき、非照射試料は5日目に大きく品質低下を示すのに対し、照射試料の品質は低下しない。更に興味ある結果は5℃貯蔵の場合について得られ、照射試料のヂェリー強度は照射直後の603gから2週間後には760gと大幅な増加を示し、品質が向上する。ヂェリー強度の経日変化をプロットすると図1-4のようになり、室温、5℃貯蔵とも照射試料の品質が非照射試料にまさること、ことに5℃貯蔵では照射試料に品質向上の見られることが明かである。
|
ヂェリ-強度(g) |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
580 |
540 |
480 |
533 |
直 後 |
570 |
670 |
570 |
603 |
| 3 日 後 |
580 |
520 |
460 |
533 |
3 日 後 |
600 |
670 |
600 |
623 |
| 5 日 後 |
500 |
500 |
450 |
483 |
5 日 後 |
600 |
670 |
600 |
623 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
39 |
37 |
32 |
36 |
直 後 |
35 |
42 |
36 |
38 |
| 3 日 後 |
35 |
36 |
30 |
33 |
3 日 後 |
35 |
43 |
35 |
38 |
| 5 日 後 |
35 |
33 |
30 |
33 |
5 日 後 |
36 |
41 |
35 |
38 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
116 |
122 |
127 |
122 |
直 後 |
118 |
119 |
118 |
118 |
| 3 日 後 |
116 |
121 |
128 |
122 |
3 日 後 |
116 |
120 |
118 |
118 |
| 5 日 後 |
120 |
123 |
129 |
124 |
5 日 後 |
115 |
117 |
115 |
116 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
8.0 |
8.0 |
8.0 |
8.0 |
直 後 |
8.0 |
8.0 |
8.0 |
8.0 |
| 3 日 後 |
7.5 |
7.5 |
7.5 |
7.5 |
3 日 後 |
8.0 |
8.0 |
8.0 |
8.0 |
| 5 日 後 |
6.5 |
6.5 |
6.5 |
6.5 |
5 日 後 |
7.8 |
7.8 |
7.8 |
7.8 |
| * X=平均値 |
|
ヂェリ-強度(g) |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
580 |
540 |
480 |
533 |
直 後 |
570 |
670 |
570 |
603 |
| 1週間後 |
570 |
530 |
530 |
543 |
1週間後 |
660 |
620 |
710 |
663 |
| 2週間後 |
660 |
640 |
650 |
650 |
2週間後 |
770 |
790 |
720 |
760 |
| 1ヶ月後 |
500 |
480 |
480 |
490 |
1ヶ月後 |
760 |
780 |
710 |
750 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
39 |
37 |
32 |
36 |
直 後 |
35 |
42 |
36 |
38 |
| 1週間後 |
32 |
29 |
27 |
29 |
1週間後 |
37 |
32 |
38 |
36 |
| 2週間後 |
32 |
31 |
32 |
32 |
2週間後 |
38 |
38 |
37 |
38 |
| 1ヶ月後 |
31 |
31 |
31 |
31 |
1ヶ月後 |
38 |
38 |
38 |
38 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
116 |
122 |
127 |
122 |
直 後 |
118 |
119 |
118 |
118 |
| 1週間後 |
120 |
116 |
119 |
118 |
1週間後 |
112 |
112 |
122 |
115 |
| 2週間後 |
118 |
118 |
120 |
119 |
2週間後 |
118 |
117 |
118 |
118 |
| 1ヶ月後 |
120 |
124 |
123 |
122 |
1ヶ月後 |
118 |
118 |
119 |
118 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
8.0 |
8.0 |
8.0 |
8.0 |
直 後 |
8.0 |
8.0 |
8.0 |
8.0 |
| 1週間後 |
7.5 |
7.5 |
7.5 |
7.5 |
1週間後 |
8.0 |
8.0 |
8.0 |
8.0 |
| 2週間後 |
7.5 |
7.5 |
7.5 |
7.5 |
2週間後 |
8.0 |
8.0 |
8.0 |
8.0 |
| 1ヶ月後 |
7.0 |
7.0 |
7.0 |
7.0 |
1ヶ月後 |
8.0 |
8.0 |
8.0 |
8.0 |
 |
前記1-1と同じ調製、照射、貯蔵を行なったかまぼこを用いた。
日本電色株式会社製の色差計を使用して、78.0%の白さをもつ標準板とかまぼこの表面及び切断面の白さを比較し、ハンター白度とした。この場合、数値の大きいほど白いことになる。
かまぼこの色はアミノーカルボニル反応の結果であると考えられるので、色の変化に伴い反応前駆体である遊離アミノ酸および還元糖量に変化があるか否かを調べた。このため試料かまぼこ25gに94mlのエタノールを加え、ブレンダーによりホモジネイトとし、これを15分間加熱還流させた。さらに80%エタノール50mlで2回同様に抽出し、抽出液は濾過後250mlとして-20℃に保存した。
遊離アミノ酸はアミノ酸分析計(日立製KLA-3A型)を用いて各アミノ酸ごとに定量した。また還元糖量はSomogyi-Nelson の方法により比色定量した.
室温貯蔵の場合の結果は表1-3および1-4に、5℃に貯蔵した場合の結果は表1-5および1-6に示す。
照射直後の表面のハンター白度は、照射試料の平均44.6%に対して、非照射試料の平均は42.5%で照射により白くなっている。ハンター白度が照射試料で平均43.9%なのに対して、非照射試料では42.4%と表面と同様に照射により白くなっている。
かまぼこの味と香について、両者の間に差はまったく認められなかったが、色の差は肉眼観察でも認められる。
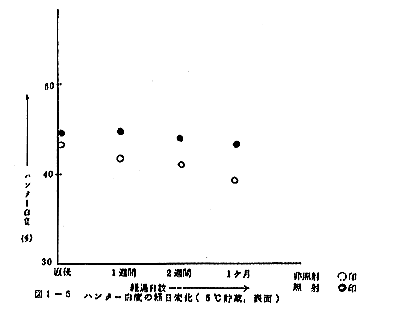
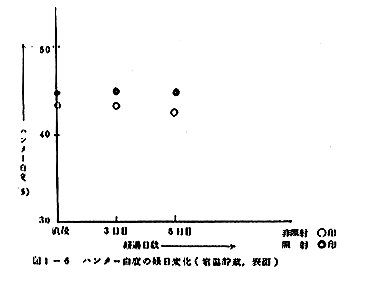
元来、かまぼこの色は貯蔵中に濃くなっていくものであり、とくに室温で保存した切断面で著しい。このことは非照射試料の切断面のハンター白度が室温貯蔵で、はじめの42.4%から5日後に33.2%に、5℃貯蔵でも42.4%から1ヶ月後に40.2%に低下することでも明かである。しかるに照射試料では、室温貯蔵で照射直後の43.9%が5日後に40.2%にと3.7%の低下をきたすのみで、非照射試料がこの間に9.2%の低下を示すのに比べて低下の割合が少ない。同様に5℃貯蔵でも照射試料のハンター白度は照射直後の43.9%から1ヶ月後の42.6%と1.3%の低下を示すのみで、非照射試料の2.2%よりも小さい。表面のハンター白度も全く同じ傾向を示し、5℃貯蔵での非照射試料で1ヶ月間に3.8%の白度低下が見られるのに対し、照射試料では1.3%のみであり、また、室温貯蔵、5日間でも非照射試料で0.8%に対し照射試料で0.1%となる。図1-5および1-6にハンター白度の経日変化を示したが、以上の関係がよくうかがわれる。
照射によりかまぼこの表面も内部もともに白くなり、しかも貯蔵中に見られる白度の低下が照射試料では少ない、との結果は、照射によりかまぼこの品質が向上したことを示すといえるだろう。
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
41.8 |
42.5 |
43.0 |
42.4 |
直 後 |
44.5 |
44.0 |
43.2 |
43.9 |
| 3 日 後 |
37.2 |
36.4 |
38.0 |
37.2 |
3 日 後 |
44.3 |
44.0 |
43.0 |
43.7 |
| 5 日 後 |
35.2 |
31.3 |
33.1 |
33.2 |
5 日 後 |
40.1 |
40.3 |
40.1 |
40.2 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
43.4 |
43.1 |
43.5 |
43.3 |
直 後 |
44.0 |
45.1 |
45.1 |
44.7 |
| 3 日 後 |
43.2 |
43.1 |
43.0 |
43.1 |
3 日 後 |
44.0 |
45.0 |
45.0 |
44.7 |
| 5 日 後 |
42.1 |
43.0 |
42.5 |
42.5 |
5 日 後 |
43.8 |
45.0 |
45.0 |
44.6 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
41.8 |
42.5 |
43.0 |
42.4 |
直 後 |
44.5 |
44.0 |
43.2 |
43.9 |
| 1週間 後 |
40.5 |
41.2 |
40.8 |
40.8 |
1週間 後 |
44.2 |
43.8 |
43.7 |
43.9 |
| 2週間 後 |
40.5 |
40.2 |
40.0 |
40.2 |
2週間 後 |
42.1 |
43.3 |
41.3 |
42.2 |
| 1ヶ月 後 |
40.5 |
40.1 |
40.0 |
40.2 |
1ヶ月 後 |
43.0 |
43.3 |
41.3 |
42.6 |
| |
非 照 射 |
照 射 |
|||||||
| 試料番号 |
1 |
2 |
3 |
X |
試料番号 |
1 |
2 |
3 |
X |
| 直 後 |
43.4 |
43.1 |
43.5 |
43.3 |
直 後 |
44.0 |
45.1 |
45.1 |
44.7 |
| 1週間 後 |
42.3 |
41.0 |
43.3 |
42.2 |
1週間 後 |
44.9 |
45.2 |
44.8 |
45.0 |
| 2週間 後 |
42.1 |
42.1 |
40.0 |
41.4 |
2週間 後 |
43.8 |
44.5 |
44.3 |
44.2 |
| 1ヶ月 後 |
40.1 |
40.3 |
38.0 |
39.5 |
1ヶ月 後 |
43.0 |
43.2 |
44.0 |
43.4 |
 |
 |
各アミノ酸の試料ごとの定量値を表1-7に示した。魚肉中には遊離のアミノ酸の他にペプチドが多く存在するため、クロマトグラム上でペプチドとアミノ酸のピークの重なりを生じ、そのためセリン、グルタミン酸、プロリン、ヒスチジンの定量はできなかった。遊離アミノ酸の主なものはグルシン、アラニン、リジンであった。
表1-7に示された非照射のかまぼこの各アミノ酸の定量値を照射したものと比較検討した結果、その間に差はないと判断される。又、かまぼこ中の遊離アミノ酸は貯蔵中に変化しないことも判明した。
かまぼこ中に存在する遊離の還元糖の総量を表1-8に示した。5℃で貯蔵したものに照射直後のものと比較して貯蔵中に若干の増加が見られたが、照射したものと非照射との間には差は見られず、かまぼこ中の還元糖に対して300kradの照射は影響を及ぼさないことがわかる。
以上のように遊離アミノ酸および還元糖についての結果は300kradの線量で処理してもアミノーカルボニル反応の前駆体に量的変化が生じにくいことを示している。従って、照射によりかまぼこの白くなる現象と、アミノ・カルボニル反応との間に関連があるか否かを判断することはできない。
|
(マイクロモル/グラム新鮮重) |
| |
貯 蔵 期 間 (日) |
||
| |
0 |
室 温 貯 蔵 |
5 ℃ 貯 蔵 |
| 3 5 |
7 14 30 |
||
| 非 照 射 |
|
|
|
| アスパラギン酸 スレオニン グリシン アラニン シスチン バリン メチオニン イソロイシン ロイシン チロシン フェニルアラニン リジン アルギニン |
0.010 0.048 0.488 0.480 0.035 0.061 0.068 0.042 0.074 0.032 0.034 0.394 0.057 |
0.009 0.048 0.456 0.464 0.030 * 0.065 0.060 0.034 0.063 0.036 0.033 0.362 0.057 |
0.008 ** ** 0.529 0.460 0.516 0.425 0.041 0.033 * 0.075 0.060 0.069 0.051 0.041 0.043 0.080 0.061 0.045 0.033 0.058 0.039 0.450 0.354 0.049 0.045 |
| アスパラギン酸 スレオニン グリシン アラニン シスチン バリン メチオニン イソロイシン ロイシン チロシン フェニルアラニン リジン アルギニン |
0.009 0.045 0.524 0.506 0.045 0.078 0.064 0.046 0.079 0.033 0.048 0.424 0.070 |
0.013 0.011 0.052 0.059 0.456 0.469 0.470 0.479 0.040 0.043 0.071 0.074 0.062 0.070 0.037 0.043 0.068 0.074 0.030 0.039 0.033 0.043 0.489 0.355 0.057 0.051 |
0.010 ** ** ** ** 0.468 0.539 0.569 0.444 0.508 0.543 0.043 0.045 0.055 0.066 0.097 0.087 0.051 0.062 0.049 0.037 0.046 0.040 0.071 0.086 0.079 0.035 0.034 0.055 0.036 0.040 0.057 0.390 0.521 0.464 0.050 0.077 0.073 |
| * 変敗したため分析せず ** クロマトグラム上のピーク分離不充分で定量不能 |
|
(mg/g新鮮重) |
| |
貯 蔵 期 間 (日) |
||
| 線 量 (krad) 0 300 |
|
室 温 貯 蔵 |
5 ℃ 貯 蔵 |
| 0 |
3 5 |
7 14 30 |
|
| 6.40 6.32 |
6.16 6.36 6.24 |
6.60 6.52 6.77 6.95 7.00 |
|
| * グルコース として表示 |
前記1-1で調製したかまぼこをそのままおよび照射処理したのち、京都大学食糧科学研究所に輸送し(客車便で15時間)、5℃で1日置いた試料を、それぞれ貯蔵期間0日の非照射および照射試料とし、以後室温に3日間および5日間、5℃に1週間、2週間および4週間貯蔵して試料とした。
試料かまぼこ2枚から直径2cmのコルクボーラーで円筒状のかまぼこ組織を12個打ち抜きその表面から0.2cmの厚さに切りとった切片を表面試料とし、その下1cmの厚さに切りとったものを内部試料とした。表面試料は切片12個(7~9g,表面面積37.7cm2)に0.005%の tween 80水溶液 200mlを加え、内部試料は切片12個(40g)に0.005%のtween 80水溶液160mlを加えた後いずれもホモジナイズし、このホモジネートについて平板培養法により全好気性細菌の生菌数を求めた。なお、好気性細菌胞子については、ホモジネートを80℃、15分間加熱した後に、平板培養して、その生菌数を求めた。
菌数測定結果は表1-9に示すとおりであって、表面の生菌数は照射前の1cm2当り 1.7×10・E(5)から、照射後5以下に、内部の場合、照射前1g当り 3.5×10・E(5)から照射後 2.0×10・E(2)と減少した。すなわち、300krad照射で存在した好気性細菌のほとんど大部分が死滅したことになる。なお、表面の生菌数減少の程度が内部におけるより大きくなった原因の一つは、表面は、内部に存在する菌よりも放射線抵抗性の弱いものが多いためであろうと思われる。
貯蔵期間中の室温は、表1-10に示したが室温貯蔵の場合、非照射試料では3日目にピークに達し以後減少するが、照射試料では5日目まで継続的に増加し、その程度は前者に比して緩やかであった。5℃貯蔵の場合は、非照射試料では1週間までほとんど変化せず(内部の場合はむしろやや減少の傾向がある)、以後徐々に増加する。照射試料では2週間まで変化せず(この場合も内部はやや減少する)、以後徐々に増加する。低温貯蔵の場合、一旦減少をみるのは、低温に弱い中温細菌の一部が死滅することによるのかもしれない。貯蔵中における生菌数の増加傾向は、室温の場合も5℃の場合もほぼ同じであった。結局300kradの照射によって室温貯蔵の場合は約5日後に照射前試料の値と同等の生菌数にまで戻り、また5℃貯蔵の場合は28日後もなお照射前試料と同じ生菌数にまで達しないことが明らかになった。
| |
貯蔵期間 |
300 krad |
0 krad |
||
| 室 温 |
5 ℃ |
室 温 |
5 ℃ |
||
| 表 面 (生菌数/c㎡) |
0 日 3 5 |
0 * 5.7×10・E(4) 2.1×10・E(5) |
|
1.7×10・E(5) 2.8×10・E(8) 0.9×10・E(7) |
1.7×10・E(5) |
| 1 週間 2 4 |
|
0 * 0~1×10・E(1) 1.8×10・E(1) |
|
2.3×10・E(5) 3.2×10・E(8) 2.3×10・E(7) |
|
| 内 部 (生菌数/g) |
0 日 3 5 |
2.0×10・E(2) 3.8×10・E(3) 1.6×10・E(4) |
2.0×10・E(2) |
3.5×10・E(5) 2.4×10・E(7) 4.9×10・E(6) |
3.5×10・E(5) |
| 1 週間 2 4 |
|
8×10・E(1) 5×10・E(0) 1.2×10・E(2) |
|
5×10・E(4) 2.1×10・E(6) 7.5×10・E(5) |
|
| * 検出限界(5個/c㎡)以下 |
| 貯蔵期間 |
温 度 |
平 均 温 度 |
| 0~1 日 1~2 2~3 3~4 4~5 |
15 ~ 21 ℃ 14 ~ 21 8 ~ 19.5 6 ~ 19 9 ~ 18 |
(18 ℃) (17.5 ℃) (15 ℃) (12.5 ℃) (13.5 ℃) |
結果は表1-11のとおりで表面の場合、照射前では、1cm2当り 6.8×10 あった生菌数が照射後には5以下まで、内部の場合には照射前、1g当り 6.0×10 あったものが、照射後には 3.0×10 まで減少した。
室温貯蔵の場合、非照射試料では、表面、内部とも3日まで増加し、以後減少するが、照射試料では、5日目までほとんど増加が認められなかった。低温貯蔵の場合は、非照射試料では、ほぼ1週間目まで減少し、後、徐々に増加した。また、照射試料では28日後まで生菌数はほとんど増加しなかった。
数回の実験で、季節により製造直後の生菌数にかなりな差がみられたが(表1-12)、これは輸送中(約15h)の温度、湿度の差によるものと思われる。
| |
貯蔵期間 |
300 krad |
0 krad |
||
| 室 温 |
5 ℃ |
室 温 |
5 ℃ |
||
| 表 面 (生菌数/c㎡) |
0 日 3 5 |
0×10・E(1) 0~4.8×10・E(1) 4×10・E(0) |
|
6.8×10・E(1) 2.0×10・E(4) 0 * |
|
| 1 週間 2 |
|
|
|
0.3~4.3×10・E(1) 9.1×10・E(1) |
|
| 4 |
|
|
|
1.0×10・E(2) |
|
| 内 部 (生菌数/g) |
0 日 3 5 |
3.0×10・E(1) 0 * 5×10・E(0) |
|
6.0×10・E(1) 6.0×10・E(3) 1.0×10・E(3) |
|
| 1 週間 2 4 |
|
5×10・E(1) 1×10・E(0) 0~4.5×10・E(1) |
|
1.0×10・E(1) 1.8×10・E(1) 4.9×10・E(2) |
|
| * 検出限界(5個/c㎡ または 5個/g) |
| (全好気性細菌) |
||||
| |
表 面 (生菌数/c㎡) |
内部(生菌数/g) |
||
| 照 射 前 |
照 射 後 |
照 射 前 |
照 射 後 |
|
| 10 月 7 月 6 月 |
2.4×10・E(5) 1.6×10・E(5) 1.4×10・E(2) |
1.9×10・E(1) 3.6×10・E(3) - |
3.5×10・E(5) 5.0×10・E(5) 2.5×10・E(2) |
2.0×10・E(2) 2.4×10・E(3) - |
| (好気性細菌胞子) |
||||
| |
表 面 (生菌数/c㎡) |
内 部 (生菌数/g) |
||
| 照 射 前 |
照 射 後 |
照 射 前 |
照 射 後 |
|
| 10 月 7 月 6 月 |
8.1×10・E(1) 2.1×10・E(1) 0.8×10・E(1) |
0×10・E(0) 3.8×10・E(1) - |
6.0×10・E(1) 1.3×10・E(2) 2.5×10・E(0) |
1.0×10・E(1) 1.5×10・E(2) |
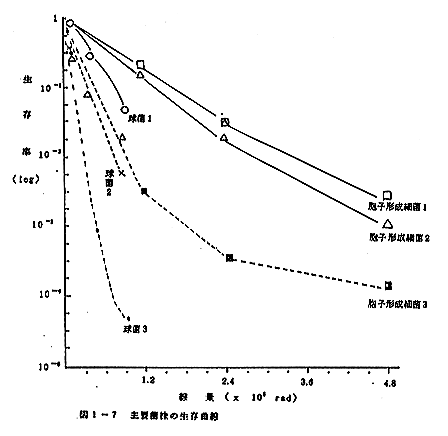
照射後貯蔵中の試料から分離された主要な菌株の生存率曲線は、図1-7にまたこれらのD10値は表1-13に示すとおりであった。
| 種 類 |
D10 値 (rad) |
| 胞子形成細菌1(Bacillus) 胞子形成細菌2(Bacillus) 胞子形成細菌3(Bacillus) 球 菌1 球 菌2 球 菌3 |
1.5 × 10・E(5) 1.35 × 10・E(5) 0.60 × 10・E(5) 1.29 × 10・E(5) 0.73 × 10・E(5) 0.56 × 10・E(5) |
 |
前記1-1と同一の試料を用いたが、照射は東京都立アイソトープ総合研究所設置のCo-60・照射器を用い、試料を回転台にのせ、吸収線量が可及的に均一になるように自転させながら行なった。室温は15℃であった。
試料かまぼこは1枚全体を細刻し、10gを採取し、20mlの滅菌嫌気性菌用稀釈水を加えブレンダーでホモジネートとし滅菌ガーゼで濾過した。このホモジネートを適当に稀釈し、炭酸ガス噴射下試験管内にあらかじめ溶融しておいたVL変法培地に注加し、ブチルゴム栓で密栓後、氷水中に回転しながら固化させ、培養に移した。培養は37℃で行ない、48時間後に発現する独立コロニーを計数して、嫌気性菌数とした。嫌気性菌数測定の際えられた独立コロニーより、コロニーの形状、色沢などを目印として釣菌し、細胞の形状を鏡検、グラム染色性をしらべた。また牛乳培地の変化、ゼラチンの消化性、硝酸塩の還元性、インドール、硫化水素の産生などを調べ、各種炭水化物の分解性もしらべた。これらの性状検査から、分離菌を幾つかの性状群にわけ、ある程度の同定を行なった。
照射直後および貯蔵中の嫌気性菌数の変動を表1-14に示す。この実験にあたって、同一かまぼこの端部、中央部など、試料採取部位別にサンプリングしたが、部位による生菌数の変動が著しいことがわかった。また、同じ処理・貯蔵日数のものについても、その試料中の生菌数にかなりの変動のあることが認められた。この実験にあたり、好気性菌数も、嫌気性菌の発育に影響するものと考えられるので、しらべた。その結果を表1-15に示す。この際も、嫌気性菌数の場合と同様に、試料ごと、また部位ごとによってかなりの変動がみられ、最大10・E(3)のオーダー変動があった。表1-14および1-15の結果から好気性菌にくらべ、嫌気性菌は1桁前後少ないことがわかるが、照射したものでは、その菌数は少ないにせよ、菌数からいって、好気性菌と嫌気性菌はほぼ同じレベルにあることがわかる。この実験試料の結果についていえば、菌数の上からいって、照射によって15℃で7日、5℃で4週間、あるいはそれ以上の貯蔵が可能であるように思われる。菌数測定のための平板上のコロニーから分離された菌は、表1-16に示すような、球菌2性状群、桿菌6性状群にわけることができた。桿菌性状群Iについては該当する菌株を指摘することはできなかったが、他の性状群については一応該当すると思われる種名を表中にあげた。しかし、これらを確定するためには、さらに標準株との詳細な比較にまたなければならない。これら菌の存在を示すと表1-17のようであり、照射しないかまぼこでは桿菌が圧倒的に優勢なミクロフローラを示すが、300krad照射したものでは、球菌もかなり含まれたミクロフローラとなる。5℃の貯蔵のものの中には、照射区にかなりの頻度で Clostridium が認められた。
| 試 料 |
照射直後 |
15℃ 貯 蔵 |
5 ℃ 貯 蔵 |
||||
| 3 日 後 |
5 日 後 |
7 日 後 |
1 週 間 後 |
2 週 間 後 |
4 週 間 後 |
||
| 非 照 射 照 射 300krad |
<10 <10 |
3×10・E(4) <10 |
7.5×10・E(3) <10 |
7.5×10・E(6) 1.5×10 |
1.5×10 <10 |
7.5×10 <10 |
6×10・E(4) 6×10 |
| 試 料 |
照射直後 |
15 ℃ 貯 蔵 |
5 ℃ 貯 蔵 |
||||
| 3 日 後 |
5 日 後 |
7 日 後 |
1 週 間 後 |
2 週 間 後 |
4 週 間 後 |
||
| 非 照 射 照 射 300krad |
3×10 <10 |
1.5×10・E(5) <10 |
2.7×10・E(7) 1.1×10 |
2.2×10・E(7) 1.5×10 |
6×10 <10 |
1.5×10・E(2) 2.5×10 |
4×10・E(5) 9×10 |
| |
牛 乳 培 地 の 変 化 |
ゼ ラ チ ン 消 化 |
炭 水 化 物 分 解 性 |
硝 酸 塩 還 元 |
イ ン ド | ル 産 生 |
硫 化 水 素 産 生 |
好 気 的 発 育 |
斜 面 上 の 発 育 |
グ ラ ム 染 色 |
性状検査の上から 一応同定しうる 菌 株 |
分 離 株 数 |
|||||||||||
| ブ ド ウ 糖 |
シ ョ 糖 |
麦 芽 糖 |
乳 糖 |
サ リ シ ン |
マ ン ニ ッ ト |
ソ ル ビ ッ ト |
キ シ ロ | ス |
ア ラ ビ ノ | ス |
マ ン ノ | ス |
澱 粉 |
グ リ セ リ ン |
|||||||||||
| 球菌 I II |
- C |
- + |
- + |
- + |
- + |
- + |
- - |
- - |
- - |
- - |
- - |
- + |
- - |
- - |
- + |
- - |
- - |
- + |
W ++ |
+ + |
Peptostrepto- coccus magnus Peptostrept- coccus evolutus |
3 1 |
| 桿菌 I II III IV V VI |
- - - C - C |
- - - - - + |
- - + + + + |
- - + + - - |
- - + + + - |
- - - + - - |
- - + + - - |
- - - + - - |
- - - - - - |
- - - + - - |
- - - + - - |
- - - + + + |
- - - - - - |
- - ± - - ± |
- + - - - + |
- - - - - ± |
- - ± - - ± |
- - - - - - |
W + + + W + |
+ + + + + + |
- Eubacterium leutum Butyribacterium rettgers Eubacterium crispatum Corynebacterium suis Clostridium sp. |
16 2 5 1 1 8 |
| |
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
|
計 |
33 |
| 菌、性 状 群 |
貯 蔵 15 ℃ |
貯 蔵 5 ℃ |
||
| 0 krad |
300 krad |
0 krad |
300 krad |
|
| 球菌 I II 桿菌 I II III IV V VI |
14 1 1 |
2 2 1 1 |
2 1 2 1 2 |
1 1 5 計 37 |
前記1-1と同一試料を用いたが、照射後の室温(20℃)および5℃での貯蔵は殺菌デシケータ中で行なった。
照射直後ならびに室温で3日間、5日間および5℃で1週間、2週間、1ヶ月貯蔵の各試料かまぼこの全体から、平均25gの量を滅菌ナイフで切りとり、小片とし、100mlの滅菌水を加えてミキサー中で無菌的にくだいて懸濁液とした。これを原液として、平面培養を行ない、生菌数を測定するとともに、異なったコロニーを分離し、純粋分離して同定を行なった。
20℃貯蔵では、生菌数はほぼ次の如く変化する。
無照射 照射
0日 10・E(6)/g 10・E(5)/g
3日 10・E(7)/g 10・E(6)/g
5日 10・E(8)/g 10・E(6)/g
従って、0日でγ線照射によって生菌数が1/10になり、5日間で照射かまぼこの生菌数は無照射かまぼこの1/100になっている。
5℃貯蔵では、貯蔵時間にともなう生菌数の増加はみられず、この温度では照射効果を明らかにできなかった。
分離した細菌は、その細菌学的性質から主として、Alcaligenes,Bacillus,Arthrobacter,Micrococcus,Pseudomonas であると考えられる。特に Bacillus はどのかまぼこにも存在し、Micrococcus は照射かまぼこに多く存在した。
20℃で貯蔵したかまぼこにみられた酵母は、すべて Rhodotorula であった。乳酸菌は分離後の生育が悪く、検討することができなかった。
1-1と同一の材料を用いた。
理化学研究所のCoガンマ線照射装置により、室温(約20℃)300krad照射した。
密閉性のよい棚付塩化ビニール製角形の箱を殺菌し、その上、下段に照射、非照射かまぼこ各5個を充分間隔をおいて入れ、5℃、20℃に保存した。
かまぼこを上記の温度で保存し3、5、7、9、11、14、17、20、23、33日後に糸状菌の発生を観察しコロニーの数を記録した。糸状菌の分離は各試料上における発育状態に応じて白金耳又は白金釣で取り、平板培養を繰り返して純粋にした後同定に用いた。又適当な時期に於いてかまぼこ上に発生した糸状菌のカラー写真を撮影した。
培地 :Malt extract agar および
Potato dextrose agar
培養温度 :25℃、30℃
培養日数 :Petri dish における分離培養は3~
7日、Slide culture は3~5
日、巨大コロニーは7日培養した。
純粋にした糸状菌は巨大コロニーを形成させ、同時にSlide cultureを併用し、培養学的性状および形態学的諸性状を調べ成書、文献、Monograph,標準菌株等を参照して同定を行なった。
5℃に保存した照射、非照射かまぼこの糸状菌の発生日数およびコロニー数を表1-18に示す。
(a)照射、包装紙を除去した場合:
23日迄糸状菌の発生はなく、33日後に初めて発生を
みた。
(b)照射、包装紙そのままの場合:
33日保存しても糸状菌の発生は認められなかった。
(c)非照射、包装紙を除去した場合:
17日迄糸状菌の発生はない。20日から生え始め23日
にPenicillium のコロニーを認めた。
(d)非照射、包装紙そのままの場合:
20日迄糸状菌の発生はない。23日から生え始め33日
にPenicillium のコロニーを認めた。
20℃に保存した場合は表1-19の如くである。
(a)照射、包装紙を除去した場合:
3日まで変化はない。5日からPenicillium,
Cladosporium,Aspergillus,
Mucor、白カビが生え始める。
7日から Rhizopus の菌糸を認めた。
(b)照射、包装紙そのままの場合:
5日迄変化なく糸状菌の発生はない。7日から
Penicillium,Rhizopus,
Aspergillus,Cladoporium,
Mucor が生え始める。
(c)非照射、包装紙を除去した場合:
3日に Penicillium、Cladospo-
rium、Rhizopus,Mucor のコロニーを
認めた。5日に Aspergillus、白カビの発生
を見た。
(d)非照射、包装紙そのままの場合:
3日に Cladosporium、Penicil-
lium、白カビ、5日に Aspergillus、
Rhizopus のコロニーが認められた。
以上の結果から20℃に保存した場合、非照射の試料では3日に糸状菌のコロニーが発生した。照射したものは5日に糸状菌の発生を見た。5℃保存の試料は糸状菌の発生が遅く非照射のものは20日後に発生、照射したものは33日後に初めて発生を見た。包装紙をそのままにして保存した場合は包装紙を除去した場合に比べ糸状菌の発生は幾分遅い。
| 試 料 |
保 存 日 数 |
|||||
| 17 |
20 |
23 |
33 |
|||
| 照 射 |
包 装 紙 除 去 |
1 |
糸状菌の発生なし |
糸状菌の発生なし |
糸状菌の発生なし |
板に糸状菌の白い小さいコロニー3個 |
| 2 |
〃 |
〃 |
〃 |
糸状菌の発生なし |
||
| 包 装 紙 そ の ま ま |
3 |
〃 |
〃 |
〃 |
〃 |
|
| 4 |
〃 |
〃 |
〃 |
〃 |
||
| 5 |
〃 |
〃 |
〃 |
〃 |
||
| 非 照 射 |
包 装 紙 除 去 |
6 |
〃 |
板に糸状菌コロニー3個 |
板にPen.のコロニー7個 |
板にPen.コロニー14個、かまぼこ上に 5個 |
| 7 |
〃 |
板に糸状菌コロニー6個 |
板にPen.のコロニー6個、 かまぼこ上に1個 |
板にPen.コロニー3個、Clad.1個、 かまぼこ上にpen.6個 |
||
| 包 装 紙 そ の ま ま |
8 |
〃 |
糸状菌の発生なし |
糸状菌の発生なし |
糸状菌の発生なし |
|
| 9 |
〃 |
〃 |
板に糸状菌コロニー2個 |
Pen.コロニー板に4個、かまぼこ上に3個 |
||
| 10 |
〃 |
〃 |
糸状菌の発生なし |
Pen.コロニー板に6個、かまぼこ上に2個 |
||
| Pen. - Penicillium Clad. - Cladosporium |
| |
保 存 日 数 |
||||||||
| 3 |
5 |
7 |
9 |
11 |
14 |
17 |
|||
| 照 射 |
包 装 紙 除 去 |
1 |
変化なし |
板にPen.か Clad.らしき コロニー1個、 Mucor1個 |
板にPen.Asp .Clad.各2個 、かまぼこ上に pen.5個 Rhiz.の菌糸ま ばらにかまぼこ全体 をおおう。 |
板にPen. Clad. コ ロニー各2個、 板の裏にAsp .2個、かまぼ こ表面にPen .コロニー9個 、Asp.コロ ニー1個、Rh iz.一面に生 えsporeを 形成 |
かまぼこの表面 にPen.一面 繁殖、その上を sporeをつ けたRhiz. がおおう |
- |
- |
| 2 |
〃 |
板に白カビコロニ ー2個、Clad .かAsp.らし きコロニー6個、 Mucor1個 |
板にPen.2個、 板の裏にAsp.1 個、かまぼこにPe n.11個、Cla d.4個、白カビ1 個、かまぼこ表面薄 いRhiz.菌糸で おおわれる |
1と略同じ。但 しRhiz.は 1よりも発育旺 盛、かまぼこの 側面及び板の間 に白カビ、黒カ ビ各1個 |
1と略同じ。但 し板の裏面にA sp.が繁殖 |
- |
- |
||
| 包 装 紙 そ の ま ま |
3 |
〃 |
変化なし |
かまぼこ表面に薄い Rhiz.のコロニ ー1個、Pen.1 個 |
Rhiz.全面 をおおう。かま ぼこの表面Pe n.コロニーが 多い |
1と略同じ |
板及びかまぼこ側 面にPen.1個 、Pen.かまぼ こ表面全体に蔓延 し始める。Rhi z.かまぼこの一 方切面に生えsp oreで黒くなる |
かまぼこ表面P en.が優勢と なる。その他 Asp.4個、 Clad.が 10個 |
|
| 4 |
〃 |
〃 |
かまぼこの切面下角 部分ピンク色になる 。Mucorコロニ ー1個 |
板にAsp.か Clad.コロ ニー1個 |
かまぼこの切面 一側にRhiz .生えspor e形成、板にP en.コロニー 1個、かまぼこ の表面に小さい Pen.コロニ ー多数 |
3と略同じ。但し かまぼこの表面に Clad.らしき コロニー12個 |
3と略同じ。但 しClad.の コロニーがやや 多く15個 |
||
| 5 |
〃 |
〃 |
かまぼこ上にAsp .かClad.らし きコロニー1個、板 とかまぼこの間に Mucor1個 |
Asp.かCl ad.コロニー 1個、かまぼこ にPen.コロ ニー生え始める |
Rhiz.とP en.包装紙上 に生える。Pe n.コロニー1 0個以上。Rh iz.かまぼこ 上に生育始める |
かまぼこの表面に Pen.コロニー 5個、Clad. らしきコロニー8 個、Rhiz.も 生えてspore 生成 |
3と略同じ。但 し他にAsp. コロニー2個、 Clad.コロ ニー7個 |
||
| 非 照 射 |
包 装 紙 除 去 |
6 |
板にPen. コロニー3個 、Clad. コロニー5個 、Mucor 1個 |
板にPen.As p.Clad.蔓 延。板の裏にもA sp.Clad発 生、板にも白カビ 発生。かまぼこ側 面にPen.コロ ニー4個 |
板にPen.Asp .Clad.多く繁 殖。かまぼこ表面に Pen.6個、Rh iz.の白い菌糸が 少し発生。板の裏面 にもPen.Cla d.相当蔓延。 |
Pen.とRh iz.が益々繁 殖、優勢となる 。 |
- |
- |
- |
| 7 |
板にRhiz .生える。 Clad.コ ロニー5個、 Mucor, 1個 |
板にPen.As p.Clad.多 く発生。Rhiz .も板の側面に発 生。かまぼこ表面 にPen.コロニ ー7個、板の裏に もClad.As p.多く生える。 |
6と殆ど同じ。但し 、Rhiz.が多く 胞子多数生成。 |
6と略同じ |
- |
- |
- |
||
| 包 装 紙 そ の ま ま |
8 |
白カビ、Cl ad.コロニ ー各1個 |
板にPen.9個 、Asp.1個、 白カビ2個、Rh iz.2個 |
Rhizの繁殖弱い 。かまぼこと板との 間にAsp.コロニ ー1個。 |
〃 |
- |
- |
- |
|
| 9 |
板にPen. コロニー3個 |
板にpen.コロ ニー7個、かまぼ こ表面にClad .コロニー2個、 Pen.2個、白 カビ2個 |
8と殆ど同じ。 |
〃 |
- |
- |
- |
||
| 10 |
板にPen. コロニー13 個、pen. の一部かまぼ こ上に繁殖 |
板にPen.蔓延 。かまぼこ上にP en.コロニー1 0個、Clad. かAsp.らしき コロニー1個 |
Rhiz.菌糸発生 、かまぼこの表面に Pen.繁殖す。 |
〃 |
- |
- |
- |
||
| Pen. - Penicillium Clad. - Cladosporium Rhiz. - Rhizopus Asp. - Aspergillus |
照射試料について分離した糸状菌の分類学的同定を行なった結果13群に区分することが出来、各群の属名、種名は次の通りである。
第1群 :Rhizopus 属
第2、3群 :Mucor 属
第4群 :Aspergillus flavus
第5群 :Penicillium janthi-
nellum
第6群 :Penicillium freque-
ntans
第7群 :Cladosporium clado-
sporioides
第8群 :Cladosporium sphae-
rospermum
第9群 :Cladosporium sp.
第10群 :Cerosporella sp.
第11群 :Cladosporium sphae-
rospermum
第12、13群:Penicillium nigri-
cans
以上13群のうち Penicillium 属と Cladosporium 属が最も多く分離された。非照射試料からも糸状菌を分離同定したが上記と同一のものが得られた。
原料、製造方法は1-1項と同様であるが、包装方法および空板の処理方法を異にする下記の試料かまぼこを用いた。
1)簡易包装(ポリセロ包装)かまぼこ
a) 1 Mrad照射板を用いて90℃加熱
b) 1 Mrad照射板を用いて非加熱
c) 3 Mrad照射板を用いて90℃加熱
d) 3 Mrad照射板を用いて非加熱
e) 非照射板を用いて90℃加熱
f) 非照射板を用いて非加熱
2)脱気包装かまぼこ
3)窒素封入包装かまぼこ
照 射:試料に0kradおよび300kradのガンマ線
照射[大阪府立放射線中央研究所のCo-60線源
(5,500Ci)を使用した。]を行なった。
貯 蔵:上記各試料を5℃および室温(20℃)で貯蔵し、
5℃貯蔵区では照射直後、1週間、2週間、4週間
後に、20℃貯蔵区では照射直後および3日後、5
日後に測定調査した。
調査・測定:かまぼこの表面および内部に存在する菌の生菌数を
測定するため、試料かまぼこを直径2cmのコルク
ボーラーで打ち抜き、その表面から2mmの厚さで
切り取ったものを表面試料とし、その下部の1cm
の厚さで切り取った部分を内部試料とした。表面試
料および内部試料は tween 80 の0.0
05%水溶液のそれぞれ 200mlおよび160
mlとともにホモジナイズしその1ml中の菌数を
計数した。
好気性細菌の生菌数は肉汁寒天培地を用いて混釈板培養し、形成されるコロニー数を計測した。
腐敗の状況は肉眼観察および写真撮影によって判定した。
各試料中の生菌数の経時変化を表1-20、1-21に示す。
これからわかるように室温(20℃)貯蔵の場合は、一般に生菌数の増加が顕著であり、特に非加熱、非照射の試料ではその傾向が大であった。
5℃貯蔵では板照射および加熱処理効果がとくに貯蔵初期にあらわれた。
包装方法としては脱気包装が最良の貯蔵効果を与え、窒素ガス封入包装、簡易包装の順であった。
300krad照射した脱気包装かまぼこでは5℃で貯蔵した場合、4週間後でも可食の状態であった。しかし室温貯蔵では1週間でネトが発生し商品価値が失われた。
窒素ガス封入かまぼこでは、脱気包装したものにくらべてかなり貯蔵性が悪く、5℃で貯蔵した場合2~3週間で商品価値はなくなった。
簡易包装では室温(20℃)貯蔵の場合、カビが発現するものもあった。肉質の軟化は20℃1週間の貯蔵で認められた。
脱気包装および窒素ガス封入包装の場合、ガンマ線を照射しないとガスの発生が認められた。又窒素ガス封入包装では2週間以上貯蔵するとかまぼこ表面が褐色に着色した。
|
(生菌数/g) |
| |
貯蔵 温度 |
表 面 |
|||
| 0 日 |
3 日 |
7 日 |
14 日 |
||
| 板非照射 非加熱 0 krad |
5゜ |
2.1×10・E(7) |
|
8.5×10・E(7) |
5.7×10・E(7) |
| 20゜ |
2.1×10・E(7) |
5.8×10・E(8) |
|
|
|
| 板非照射 非加熱 300 krad |
5゜ |
5.3×10・E(1) |
|
4.9×10・E(6) |
- |
| 20 |
5.3×10・E(1) |
1.5×10・E(5) |
|
|
|
| 板非照射 加 熱 300 krad |
5゜ |
3.4×10・E(2) |
|
- |
1.3×10・E(4) |
| 20゜ |
3.4×10・E(2) |
7.9×10・E(3) |
|
|
|
| 板 1 Mrad 非加熱 300 krad |
5゜ |
5.3×10・E(1) |
|
- |
1.6×10・E(4) |
| 20゜ |
5.3×10・E(1) |
1 ×10・E(4) |
|
|
|
| 板 1 Mrad 加 熱 300 krad |
5゜ |
2.1×10・E(2) |
|
1.1×10・E(4) |
{1.3×10・E(3)} |
| 20゜ |
2.1×10・E(2) |
5.3×10・E(3) |
|
|
|
| 板 3 Mrad 非加熱 0 krad |
5゜ |
4.9×10・E(6) |
|
6.9×10・E(7) |
{7.9×10・E(5)} |
| 20゜ |
4.9×10・E(6) |
1.3×10・E(8) |
|
|
|
| 板 3 Mrad 非加熱 300 krad |
5゜ |
0 |
|
8.4×10・E(3) |
{5.2×10・E(2)} |
| 20゜ |
0 |
2.4×10・E(5) |
|
|
|
| 板 3 Mrad 加 熱 300 krad |
5゜ |
2.7×10・E(1) |
|
5.3×10・E(2) |
- |
| 20゜ |
2.7×10・E(1) |
5.3×10・E(4) |
|
|
|
| |
貯蔵 温度 |
||||
| 0 日 |
3 日 |
7 日 |
14 日 |
||
| 板非照射 非加熱 0 krad |
5゜ |
1.3×10・E(7) |
|
9.0×10・E(7) |
3.2×10・E(6) |
| 20゜ |
1.3×10・E(7) |
7.7×10・E(8) |
|
|
|
| 板非照射 非加熱 300 krad |
5゜ |
7.6×10・E(3) |
|
8.4×10・E(5) |
9.8×10・E(3) |
| 20 |
7.6×10・E(3) |
3.3×10・E(4) |
|
|
|
| 板非照射 加 熱 300 krad |
5゜ |
6.8×10・E(2) |
|
5.0×10・E(2) |
1.5×10・E(4) |
| 20゜ |
6.8×10・E(2) |
1.0×10・E(4) |
|
|
|
| 板 1 Mrad 非加熱 300 krad |
5゜ |
3.2×10・E(1) |
|
7.6×10・E(4) |
9.2×10・E(2) |
| 20゜ |
3.2×10・E(1) |
8.3×10・E(3) |
|
|
|
| 板 1 Mrad 加 熱 300 krad |
5゜ |
6.5×10・E(1) |
|
1.4×10・E(3) |
2.4×10・E(3) |
| 20゜ |
6.5×10・E(1) |
2.8×10・E(3) |
|
|
|
| 板 3 Mrad 非加熱 0 krad |
5゜ |
2.8×10・E(5) |
|
1.2×10・E(7) |
- |
| 20゜ |
2.8×10・E(5) |
5.6×10・E(7) |
|
|
|
| 板 3 Mrad 非加熱 300 krad |
5゜ |
0 |
|
4.8×10・E(3) |
- |
| 20゜ |
0 |
2.4×10・E(4) |
|
|
|
| 板 3 Mrad 加 熱 300 krad |
5゜ |
0 |
|
1.4×10・E(3) |
9.3×10・E(3) |
| 20゜ |
0 |
3.8×10・E(4) |
|
|
|
|
(生菌数/g) |
| |
貯蔵 温度 |
表 面 |
|||
| 0 日 |
3 日 |
7 日 |
14 日 |
||
| 簡易包装 300 krad 照 射 |
5゜ |
1.3×10・E(1) |
|
1.5×10・E(4) |
3.4×10・E(3) |
| 20゜ |
1.3×10・E(1) |
1.3×10・E(4) |
|
|
|
| 脱気包装 非照射 |
5゜ |
0×10・E(0) |
|
1.3×10・E(5) |
2.9×10・E(5) |
| 20 |
0×10・E(0) |
1.9×10・E(6) |
|
|
|
| 脱気包装 300 krad 照 射 |
5゜ |
1.3×10・E(1) |
|
1.5×10・E(3) |
2.1×10・E(3) |
| 20゜ |
1.3×10・E(1) |
4.8×10・E(2) |
|
|
|
| 窒素ガス封入包装 非照射 |
5゜ |
7.9×10・E(1) |
|
2.9×10・E(4) |
5.3×10・E(5) |
| 20゜ |
7.9×10・E(1) |
6.4×10・E(7) |
|
|
|
| 窒素ガス封入包装 300 krad 照 射 |
5゜ |
2.7×10・E(2) |
|
2.1×10・E(2) |
3.7×10・E(4) |
| 20゜ |
2.7×10・E(2) |
2.8×10・E(4) |
|
|
|
| |
貯蔵 温度 |
||||
| 0 日 |
3 日 |
7 日 |
14 日 |
||
| 簡易包装 300 krad 照 射 |
5゜ |
1.9×10・E(3) |
|
- |
1.2×10・E(4) |
| 20゜ |
1.9×10・E(3) |
2.0×10・E(4) |
|
|
|
| 脱気包装 非照射 |
5゜ |
0×10・E(0) |
|
4.6×10・E(4) |
4.1×10・E(4) |
| 20 |
0×10・E(0) |
3.0×10・E(6) |
|
|
|
| 脱気包装 300 krad 照 射 |
5゜ |
9.0×10・E(2) |
|
1.9×10・E(2) |
1.4×10・E(3) |
| 20゜ |
9.0×10・E(2) |
5.6×10・E(2) |
|
|
|
| 窒素ガス封入包装 非照射 |
5゜ |
6.9×10・E(2) |
|
1.9×10・E(4) |
2.4×10・E(5) |
| 20゜ |
6.9×10・E(2) |
1.6×10・E(6) |
|
|
|
| 窒素ガス封入包装 300 krad 照 射 |
5゜ |
6.9×10・E(1) |
|
3.2×10・E(2) |
4.6×10・E(3) |
| 20゜ |
6.9×10・E(1) |
6.1×10・E(3) |
|
|
|
1) 300kradの照射は生菌数の増加をおさえた。
2) 室温(20℃)貯蔵では生菌数の面からみて3日後までは
照射効果もあったが、5日後には商品価値はなくなった。
3) 板をあらかじめ照射した場合、20℃で貯蔵すると3日間
はその効果が認められた。5℃貯蔵では2週間まで効果があ
らわれた。
4) 板照射のための線量は1Mradでほぼ充分であった。
前記1-1と同じかまぼこを試料として、貯蔵中における腐敗状況および微生物生菌数の変化に対する板照射の影響、加熱時間の影響ならびに板の照射と加熱との併用効果をしらべた。このため板照射、包装、二次照射に関する製造工程を部分的に変えた下記の試料かまぼこを用いた。
a) 1Mrad照射板を用いて80~85℃で40分加熱
b) 1Mrad照射板を用いて80~85℃で25分加熱
c) 300krad照射板を用いて80~85℃で40分
加熱
d) 300krad照射板を用いて80~85℃で25分
加熱
e) 非照射板を用いて80~85℃で40分加熱
f) 非照射板を用いて80~85℃で25分加熱
g) 1Mrad照射板を用いて80~85℃で25分加熱
し、300kradの二次照射
h) 1Mrad照射板を用いて80~85℃で25分加熱
し、二次照射せず
i) 非照射板を用いて80~85℃で25分加熱し、300
kradの二次照射
j) 非照射板を用いて80~85℃で25分加熱し、二次
照射せず
a) 1Mrad照射板を用い80~85℃で25分加熱し、
300kradの二次照射
b) 1Mrad照射板を用いて80~85℃で25分加熱し、
二次照射せず
c) 非照射板を用いて80~85℃で25分加熱し、300
kradの二次照射
d) 非照射板を用いて80~85℃で25分加熱し、二次照射せ
ず
空板に対する1Mradおよび300kradの照射は理化学研究所のCo-60 γ線照射装置を用いて行い、300kradの二次照射には大阪府立放射線中央研究所のCo-60 線源を用いた。
上記各試料を10℃および室温(または20℃)で貯蔵し、10℃貯蔵区では照射直後、3日後、8日後、14日または15日後に、室温(20℃)貯蔵区では照射直後、1日後、3日後および8日後に調査測定した。
かまぼこの表面および内部に存在する微生物の生菌数を測定するため試料かまぼこを直径2cmのコルクボーラーで打ち抜き、その表面から2mmの厚さで切り取ったものを表面試料とし、その下部の1cmの厚さで切り取った部分を内部試料とした。表面試料および内部試料はTween 80 の 0.005%水溶液のそれぞれ 200mlおよび160mlとともにホモジナイズし、その1ml中の生菌数を計数した。
好気性細菌の生菌数は肉汁寒天培地を用いて混釈平板培養し、形成されるコロニー数を計測した。腐敗の状況は肉眼観察および写真撮影によって判定し、糸状菌の観察にはグルコース添加馬鈴薯寒天培地(pH5.5)を用いた。
まず簡易包装かまぼこの(ia)、(ib)、(ic)、(id)、(ie)、(if)の各試料を10℃と室温で貯蔵し腐敗の進行状況および生菌数の変化を比較検討した。この実験は7月中旬と11月中旬に行ったが、その結果、7月の実験では表面の生菌数に関しては、10℃貯蔵の場合には、貯蔵後8日目に、室温貯蔵では貯蔵後3日目に、板を照射した試料の生菌数が板照射を行わなかった試料のそれにくらべてわずかに高くなる傾向が見られたが、11月の実験ではこのような傾向は見いだされなかった。いずれの場合も内部の生菌数には差がなく、また板照射線量の大小(1Mradと300krad)も加熱時間の長短(40分と25分)も生菌数の増加および腐敗の進行状態に対して、とくに明瞭な影響を与えなかった。11月の実験では糸状菌および酵母の生育状況についても調査したが、これらの点でも板照射の有無ならびに加熱時間の長短による差異は認められなかった。本年度の結果と昭和46年度の結果とを併せて考察するとつぎのことがいえる。すなわち、かまぼこの製造条件および原料の質は製造の時期によってかなり大きい差があり、それにともなって製品の微生物学的性状も異なるため、板照射や加熱の効果の現われ方が製造製品のロットによって大幅に違ってくる。板照射の効果は使用する板の微生物による汚染度が高いときには見られるが、板の汚染度が低い場合には見られなくなるものと考えられた。また加熱時間は25分の場合も40分の場合も貯蔵効果の上で大きい違いはないように思われた。
そこで最後に、包装および二次照射と、板照射と併用して、総合的にどのような貯蔵効果が現われるかを検討するために、前記(ig)、(ih)、(ii)、(ij)、(iia)、(iib)、(iic)および(iid)の試料を10℃で貯蔵し、貯蔵中における生菌数の変化をしらべ、同時に腐敗の進行状況を観察した。
これらのデータからわかるように、各試料間の差異はかなり大きかったが、全体的にみてつぎのことがいえる。
(1) 300kradの二次照射はきわめて有効であり、これを
行った試料では表面、内部とも15~17日間の貯蔵期間中
に生菌の増加はほとんど見られず、つねに1cm3または1g
中に10以下であった。この場合、簡易包装と脱気包装の間
に明瞭な差異は認められなかった。二次照射は糸状菌の発生
を抑制する結果をも示した。
(2) 板照射は糸状菌の発生を抑制する効果があり、非照射板を
用いた試料では3週間貯蔵後に糸状菌の生育が見られたが、
照射板を用いた試料では板の部位における糸状菌の発生は見
られなかった。
現在までに得られたデータ全体から考察すると一応つぎの
ことが結論としていえるように思われる。すなわち300k
radまたは1Mradの照射を施した板を用いて調製した
かまぼこを脱気包装して25分間加熱した後、300kra
dの照射を行い、5℃または10℃に貯蔵することによって
かまぼこの貯蔵期間をかなり延長することができ、少なくと
も15日間はほとんど微生物学的品質の低下をきたすことな
しに貯蔵できる。
その結果を表1-22、表1-23に示した。
|
貯蔵中におけるかまぼこ(*)の表面生菌数の変化と板照射および二次照射との関係 (表面1c㎡あたりの生菌数) 簡易包装の場合: |
| 板照射の線量 二次照射の線量 |
0 krad 0 krad |
0 krad 300 krad |
1 Mrad 0 krad |
1 Mrad 300 krad |
|
| 貯 蔵 日 数 |
0 3 8 15 |
5.16×10・E(3) 3.09×10 3.47×10・E(4) 1.52×10・E(7) |
< 10 < 10 < 10 < 10 |
2.06×10・E(3) 3.12×10・E(2) 3.71×10・E(4) 4.19×10・E(4) |
< 10 < 10 < 10 < 10 |
| 板照射の線量 二次照射の線量 |
0 krad 0 krad |
0 krad 300 krad |
1 Mrad 0 krad |
1 Mrad 300 krad |
|
| 貯 蔵 日 数 |
0 4 9 17 |
1.42×10・E(3) 5.56×10・E(3) 2.21×10・E(5) 5.52×10・E(6) |
< 10 < 10 < 10 < 10 |
2.24×10・E(3) 8.07×10 2.35×10・E(5) 3.06×10・E(4) |
< 10 < 10 < 10 < 10 |
| (*) 加熱時間は25分、貯蔵温度は10℃とした。 |
|
貯蔵中におけるかまぼこ(*)の内部生菌数の変化と板照射および二次照射との関係 (内部1gあたりの生菌数) 簡易包装の場合: |
| 板照射の線量 二次照射の線量 |
0 krad 0 krad |
0 krad 300 krad |
1 Mrad 0 krad |
1 Mrad 300 krad |
|
| 貯 蔵 日 数 |
0 3 8 15 |
4.20×10・E(4) 3.74×10・E(4) 6.49×10・E(5) 4.41×10・E(6) |
< 10 < 10 < 10 < 10 |
2.57×10・E(5) 1.27×10・E(6) 3.37×10・E(5) 3.33×10・E(5) |
< 10 < 10 < 10 < 10 |
| 板照射の線量 二次照射の線量 |
0 krad 0 krad |
0 krad 300 krad |
1 Mrad 0 krad |
1 Mrad 300 krad |
|
| 貯 蔵 日 数 |
0 4 9 17 |
7.02×10・E(5) 1.45×10・E(5) 1.77×10・E(7) 5.39×10・E(6) |
< 10 < 10 < 10 < 10 |
2.34×10・E(6) 8.91×10・E(3) 4.16×10・E(7) 7.86×10・E(6) |
< 10 < 10 < 10 < 10 |
| (*) 加熱時間は25分、貯蔵温度は10℃とした。 |
前記1-1で調製したかまぼこを氷冷下で空輸し、1本づつアルミ箔に包んで、北海道大学設置のCo-60γ線照射装置により300kradの線量の照射を行った。そののち1-1の試料と同じく、室温で3日間および5日間、5℃で1週間、2週間および1ヶ月間の貯蔵を行い、照射直後の試料とともに試験に供した。
パネル(13人)による官能検査で、におい、味および色について対照との比較を行なった。
それぞれの試料について175g(約1本)を細かく切り、100mlの水を加えてミキサーでかゆ状とし、シリコンゴム栓をした500mlの三角フラスコに入れ、予め50mlまで脱気しておく。湯浴中で90℃に加熱して得られる head space vapor 5mlを柳本GCG-550FP型に注入してガスクロマトグラムを得た。カラムはReoplex 400,EGA,ES-30,OV-17 等を用いたが、なかでも20% Reoplex 400(担体、酸洗C-22,60~80メッシュ)、1.5m×5mm(内径)ステンレスカラムで最も良好な分離が得られた。カラム温度は50℃、120℃および昇温法で行なった。窒素ガスの流速は約20ml/minを用いた。
成分の確認を行なう目的で、試料に同量の水を加えてミキサーでかゆ状とした後、90℃に加熱して発生する揮発成分を窒素ガスでイソペンタンを含むあるいは含まないドライアイスエタノールで冷却したトラップに導き、濃縮してから日立製のGC/MS分析装置(ガスクロマトグラフ:日立K-53、質量分析計:日立RMS-4)を用いて分離確認を試みた。
(1) パネルによる官能検査は、におい、味両者とも300kr
ad照射した方がやや良好で、色調も対照と比べて幾分漂白
されているという結果を得た。においについて述べると、訓
練されていないパネルであるが、13人中9人は差を認め、
うち5人は対照よりも良好であるとし、また5人は対照より
においが強いと表現している。
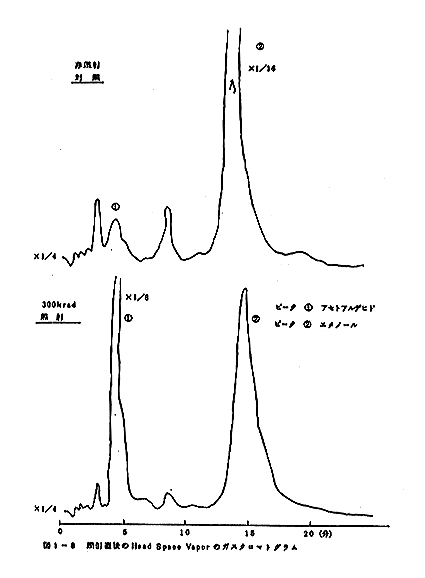
(2) Reoplex 400 カラムを用い、カラム温度50
℃で行なった head space vapor のガス
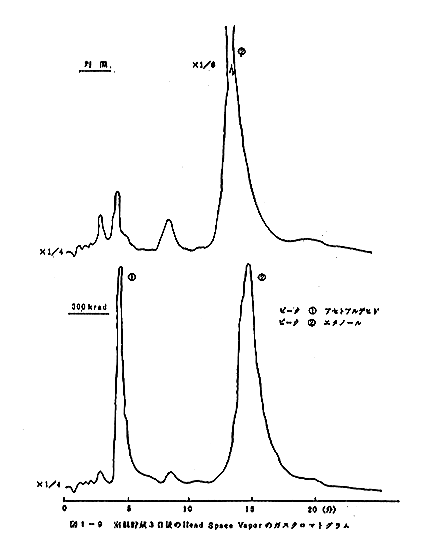
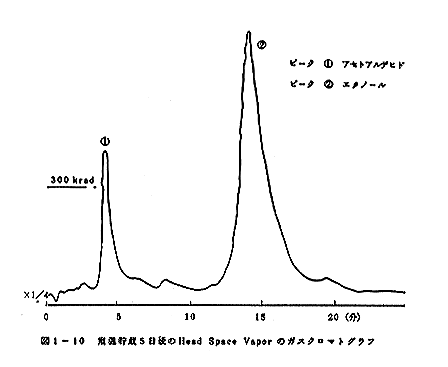
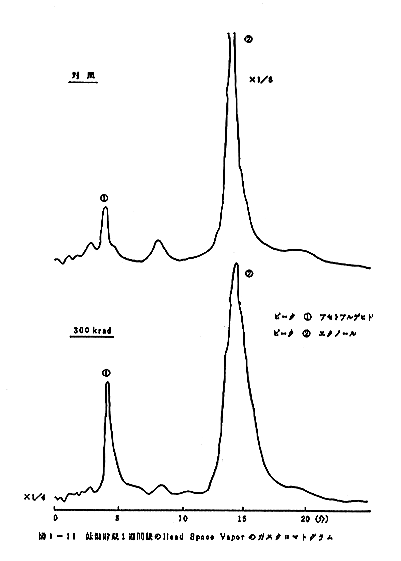
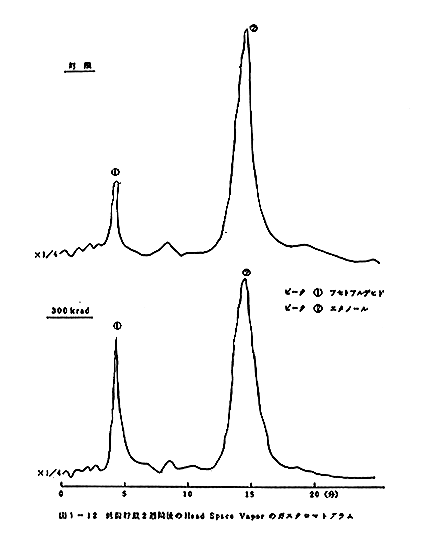
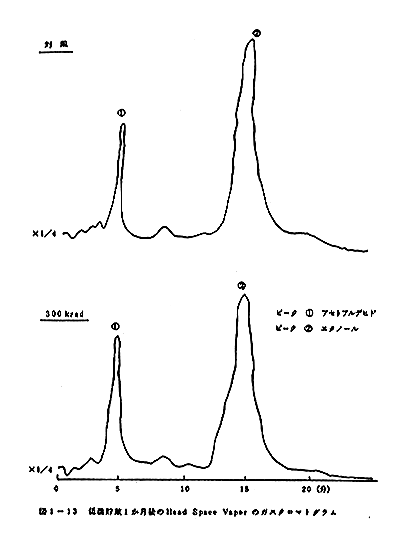
クロマトグラムのパターンの比較を図1-8、図1-9、図
1-10、図1-11、図1-12、図1-13に示す。室
温に貯蔵した場合には5日後の試料では変敗が著しく、ガス
クロマトグラムをとらなかった。なお300krad照射試
料でも変敗が見られたが、ガスクロマトグラムのパターンに
顕著な違いは見られなかった。また、5℃貯蔵の場合には対
照は2週間後、300krad照射の試料では1ヶ月後に変
敗が見られた。
ガスクロマトグラムの比較から300krad照射の試料
では、アセトアルデヒト等のより揮発性の成分の量が相対的
に増加するようである。なお、長期間低温に貯蔵すると対照
と300krad照射試料のガスクロマトグラムの間におけ
る差が小さくなる傾向が見られた。
(3) 揮発性成分を濃縮してGC/MS分析装置で成分の分離確
認を試みた結果、head space vapor のガ
スクロマトグラムの主ピークであるエタノールおよびアセト
アルデヒトを確認した。
 |
 |
 |
 |
 |
 |
前記1-1と同じ試料を用いた。
照 射:試料のかまぼこを製造後なるべく速やかに入手し、
約1日後に名古屋大学Co-60 γ線照射装置に
より室温でγ線照射を行なった。
照射線量は300krad(線量率 2.4×
10・E(4)rad/hr)であり非照射試料も
照射試料と同じ温度に同時間放置した。照射試料は
、非照射試料とともに次の4区分について分析を行
なった。
1) 直後
2) 室温に3日間放置後
3) 5℃の冷蔵庫に保存し、1週間後
4) 同上のもの2週間後
分析方法:試料のかまぼこの両端を除き細断したものから無作
為に細片を集めたもの10gに蒸留水30mlを加
えブレンダーに30sec5回にかけてホモジネー
トとし、これを60℃に30分間加温したのち60
00rpm 10分間の遠心分離を行なって上澄液
を集めた。残渣は更に水300mlを加えて同様の
処理を再度行なった。これらの上澄液を集めて10
mlとし分析用抽出液とした。
この分析用抽出液1mlに内部標準イノシトール溶
液(200ml/100ml)1mlを加え凍結乾
燥してTMS化してガスクロマトグラフィーを行な
い内部標準に対する面積比から求めた検量線から、
しょ糖及びソルビトールの定量を行なった。
◎ガスクロマトグラフィーの条件
凍結乾燥した試料を1mlの無水ピリジンに溶かし、Hexamethyldisilazane(HMDS) 0.4ml Trimethylchlorosilane(TMCS) 0.2mlを加え密栓して70℃10分間加熱反応させトリメチルシリル(TMS)化を行なった。この1μlを次の条件で分析した。
日立K53型ガスクロマトグラフFID、ステンレスカラム2mSE52 3% on chromosorb W を充填。カラム温度 200℃ isothermal 次に300℃まで4℃/minで昇温。Injection 温度280℃。N21.0kg/cm3。H2 0.7kg/cm3。Air 1.5kg/cm3。
前記の1) 2) 3) 4)の条件においた試料について、しょ糖及びソルビトールの定量を行なったが、これらの含有量は試料のケースにより多少異なっており、またその照射による変動も幾分相違がみられたので3回の実験結果をまとめたものを最終結果として図1-14に示した。次のような結論が得られた。
1) 照射直後のものを比較した場合、しょ糖もソルビトールも
ともに300kradの照射によりごく僅かの低下が見られ
た。
2) 照射後室温に放置した場合。しょ糖は非照射の対照区では
3日後に20%以上の低下がみられたが、300krad照
射区ではその低下が少なかった。
一方ソルビトールは3日後でもあまり低下は見られなかっ
た。
3) 照射後5℃に保存した場合。しょ糖は非照射区では7日後、
15%、14日後35%の低下が見られたが、300krad
照射区では殆ど低下が見られなかった。ソルビトールは非照射
区、照射区ともに7日後及び14日後にもあまり変化は見られ
なかった。
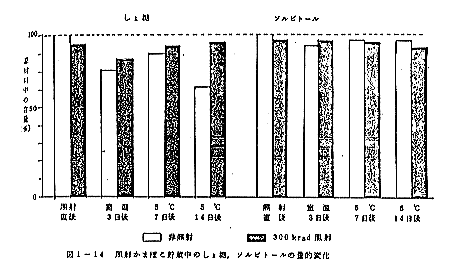 |
かまぼこ中のしょ糖、ソルビトール含量の保存中の変化をしらべた結果、非照射の場合、しょ糖は室温で3日後、5℃でも14日後にはかなり低下がみられたが、これはかまぼこの腐敗、微生物の増殖と関連しているものと考えられる。これに対し、300krad照射したものはその低下が少なく保存性の良好なことを示している。
一方ソルビトールは非照射のものでも低下が少なく、微生物による分解をうけがたいことを示しているが、照射した場合も殆んど低下が認められなかった。
1-1項と同じ試料を用いた。すなわち原料と配合割合は規格通りの板付かまぼこで保存料は含まない。研究対象の重合リン酸塩はポリリン酸ナトリウム 50%、ピロリン酸ナトリウム 50%から成る商品名”タリンサン” 0.2%が、またグルタミン酸ナトリウム(MSG) 0.1%が原料すり身に添加された。
(1) 照射による重合リン酸塩の分解と重合の生起をみるため、
0.2%トリポリりん酸塩水溶液を照射し、松橋法で単量体
から12量体までの分画をして水解後リン酸定量をした。非
照射水溶液も定量し、両者を比較した。
(2) タリンサン中のリン酸形態と含有比をみた。
(3) かまぼこから除蛋白して重合リン酸塩を抽出するのに過塩
素酸(PCA)を用いる。これが重合リン酸塩水解の原因と
なりうるので、除蛋白条件と同じPCA濃度、放置時間のも
とで重合リン酸塩の水解率、2量体、単量体の生成率をみた
。
(4) 照射によるかまぼこ中の重合リン酸塩の変化をみるため3
00kradの照射後、5℃と15℃に貯蔵し、5℃の時は
照射直後、1週間、2週間後に、15℃の時は3、5および
7日後に重合リン酸塩を抽出・分画し、リン酸定量をした。
非照射かまぼこについても同様に処理し定量した。
(5) 照射による水溶液MSGの分解をみるため2%MSG水溶
液を照射し、残存MSGと生成NH3量をみた。
(6) 照射によるかまぼこ中のMSGの変化をみるため、照射、
貯蔵条件は(4)と同じにしMSGを抽出し、Fernan
dez-Florires法を採り入れた分画を行ない、
Formal滴定により残存MSGを定量しその変化をみた
。
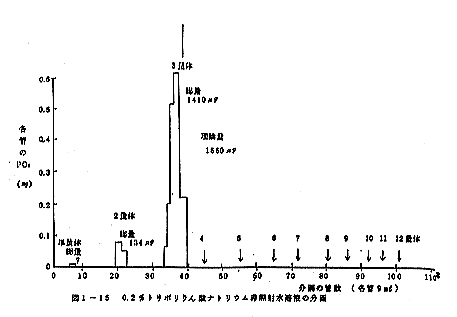
(1) 非照射水溶液中の重合リン酸塩の分画定量結果は図1-
15に示した。3量体は1410μg,2量体は134μ
g,単量体は7μgが1ml中に検出され、4量体以上は
含まれなかった。300、2490および4380kra
d照射後の各形態のリン酸塩は表1-24に示した。照射
しても、非照射の場合と各画分のリン酸量は変わらなかっ
た。よってトリポリリン酸ナトリウムは照射によって分解
も重合もしないことが判明した。
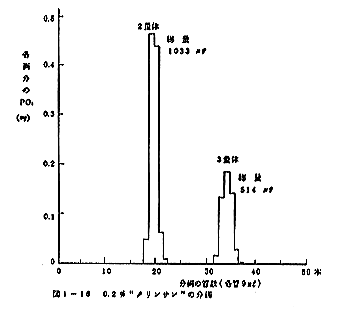
(2) タリンサンの分析結果は図1-16に示した。2量体と
3量体の比は1:1でなく、2:1であった。
(3) PCAによる重合リン酸3量体の加水分解率は表1-2
5に示すように2.9%であり、2量体に1%、単量体に
1.9%の割合で変化した。かまぼこから重合リン酸塩を
抽出する時の添加PCAによる3量体の水解の影響は少な
いことが判明した。
(4) 照射前後および貯蔵中におけるかまぼこ中の重合リン酸
塩の形態ならびに含量変化は表1-26に示した。加えた
重合リン酸塩は、試験開始前に全量が単量体に変化してい
た。15℃貯蔵の照射区では非照射区より僅かに単量体増
加の傾向がみられたが、5℃貯蔵の区ではこの傾向はみら
れなかった。重合リン酸塩はPCA除蛋白操作で破壊を受
けないので、すり身の中で3量体から単量体に変化したも
のと推定された。
(5) 2%MGS水溶液を照射した場合の破壊状況は表1-2
7に示した。破壊率はきわめて小さく、300krad照
射による破壊量は平均0.00047 Mol と計算さ
れた。これは添加MSGの0.44%の破壊量に過ぎない
。0.01Mrad当りの破壊量は1.28×10・E(
-5)Molで、クロルテトラサイクリン、フリルフラマ
イド、デヒドロ酢酸などの保存料の破壊量と変わらない。
したがってMSGのように多量に加える食品添加物の破壊
率が低くなるのは当然である。MSG破壊は脱アミノ破壊
を伴うが、その破壊は約35%の割合で起こった。
(6) 300krad照射ならびに貯蔵中におけるかまぼこ中
のMSG変化は表1-28に示した。照射によって起るか
まぼこ中のMSGの変化は少ない。これはMSGのみ無添
加のかまぼこを照射すれば、表1-29に示すように増加
するためと推定された。貯蔵中、MSG含量の上に特に目
立つ変化は認められなかった。
|
0.2%トリポリりん酸ナトリウム水溶液のγ線照射による変化 |
| |
単量体 |
2量体 |
3量体 |
| 非 照 射 区 300 krad 照射区 2490 krad 照射区 4380 krad 照射区 |
7.1 5.5 8.1 6.2 |
134 134 139 130 |
1410 1427 1378 1392 |
| 各画分の濃度は1ml中のPO4μgで示した。 |
|
重合りん酸塩のPCA水溶液中における加水分解および2量体、単量体の生成 |
| |
|
初 濃 度 (μg/ml) |
6%PCA12分処理 後の濃度(μg/ml) |
加水分解量 (μg/ml) |
加水分解率と 生成率(%) |
| 0.2%トリポリ りん酸 ナトリウム |
3量体 2量体 単量体 |
1410 134 7 |
1369 148 34 |
-41 +14 +27 |
-2.9 +1.0 +1.9 |
|
300krad照射ならびに貯蔵中における”かまぼこ”中の重合りん酸塩の形態と変化 (単位:mg%) |
| 保蔵温度 |
区 分 |
りん酸形態 |
貯 蔵 日 数 |
|||||
| 0 |
3 |
5 |
7 |
14 |
17 |
|||
| 15℃ |
非 照 射 |
単 量 体 二 量 体 三 量 体 |
185 0 0 |
208 0 0 |
206 0 0 |
190 0 0 |
|
|
| 照 射 |
単 量 体 二 量 体 三 量 体 |
192 0 0 |
217 0 0 |
212 0 0 |
199 0 0 |
|
|
|
| 5 ℃ |
非 照 射 |
単 量 体 二 量 体 三 量 体 |
185 0 0 |
- - - |
- - - |
206 0 0 |
212 0 0 |
|
| 照 射 |
単 量 体 二 量 体 三 量 体 |
192 0 0 |
- - - |
- - - |
155 0 0 |
212 0 0 |
- - - |
|
|
2%MSG水溶液のγ線照射による破壊 |
| |
MSG残存量 (M) |
MSG変化量 (M) |
300krad 当たり破壊量 (M) |
変化率 (%) |
NH3生成量 (M) |
脱アミノ破壊 |
| 全体破壊 |
||||||
| 非 照 射 区 3000krad照射区 6000krad照射区 9000krad照射区 |
0.1069 0.1004 0.0992 0.0955 |
0 0.0065 0.0077 0.0114 |
0 0.00065 0.00039 0.00038 |
0 6.1 7.2 10.7 |
0 0.0018 0.0031 0.0043 |
0 28 40 38 |
| 平均 0.00047 平均 35 |
||||||
|
300krad照射ならびに貯蔵中における”かまぼこ”中のグルタミン酸ナトリウムの含量変化 (単位:mg%) |
| 保蔵温度 |
区 分 |
貯 蔵 日 数 |
|||||
| 0 |
3 |
5 |
7 |
14 |
17 |
||
| 15 ℃ |
非 照 射 |
690 |
734 |
768 |
754 |
|
|
| 照 射 |
721 |
787 |
718 |
714 |
|
|
|
| 5 ℃ |
非 照 射 |
690 |
- |
- |
771 |
733 |
- |
| 照 射 |
721 |
- |
- |
843 |
764 |
- |
|
|
γ線照射によるMSG無添加かまぼこ中にみられるMSGの生成 |
| 照射線量(krad) |
0 |
300 |
600 |
| MSG含量(mg%) |
64 |
77 |
195 |
 |
 |
前記1-1と同様に調製、照射ならびに室温(20℃)で3日間、5日間及び5℃で1週間、2週間、4週間の貯蔵を行ない試料としたが、かまぼこの原料擂潰に際してソルビン酸カリを2,000ppmまたは2-(2-フリル)-3-(5-ニトロ-2-フリル)アクリル酸アミド(以下FFと略す) 2.5ppmを加え、保存料添加かまぼこを製造して用いた。
全試料かまぼこについて、その表面の付着微生物群の変化、揮発性塩基窒素ならびに添加ソルビン酸あるいはFFの含量変化を追及した。なおソルビン酸については照射分解生成物の有害性を検討するために、ソルビン酸水溶液を照射し、残存率100、50および20%となし、エーテル抽出をおこない、質量分析により生成物の構造を推定した。FFについては、かまぼこ中での照射との併用による効果が見られぬことが判明したので、生成物の追及はしなかった。
ソルビン酸もFFも蛋白SH基と付加反応を起こし易く、かまぼこをつくる時、その加熱中にこれらの保存料の含量は低下した。ソルビン酸の場合には2,000ppmから1,450ppmに、FFでは2.5ppmから1.6ppmとなった。
照射により含量は急激に減少し、図1-16に示すように、1,450ppmから980ppmに低下した。20℃と5℃に保蔵した場合、含量は徐々に低下した。低温程低下は緩慢に示された。しかし、保蔵期間中大部分のソルビン酸は残存した。
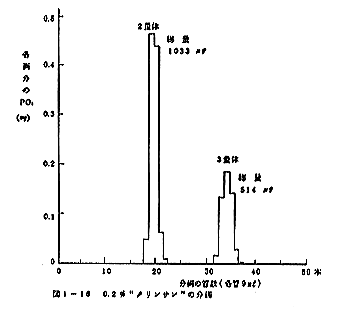 |
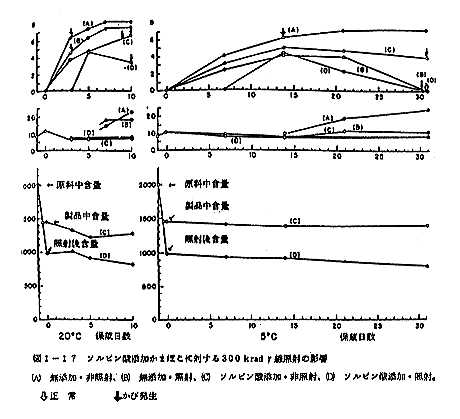
図1-17に見るように、照射によって揮発性塩基窒素が特に増えることは観察されなかった。しかし、ソルビン酸無添加の非照射区分(A)および照射区分(B)は、20℃において3日以後、5℃において2週間後増大を示した。
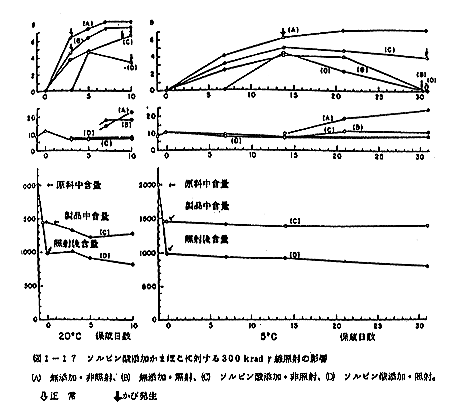 |
結果を図1-17に示した。ソルビン酸添加照射区(D)のみが20℃において3日後、5℃において1週間後も菌の増殖を認めなかった。しかし他の試験区では直ちに菌の増殖が認められた。保蔵期間末期に至って、照射区のみ菌は減少するか、あるいは消滅し、非照射区と著しく異なった。
 |
FF含量1.6ppmのかまぼこを照射した場合の結果は図1-18に示した。照射により急激に減少し0.006ppmとなり、実質上破壊しつくされた。FF含量1.6ppmの非照射かまぼこを20℃および5℃に保蔵した場合、速やかに減少し、20℃では5日目に0.1ppmとなり、実質上消失と見做された。5℃では1ヶ月後に消失した。
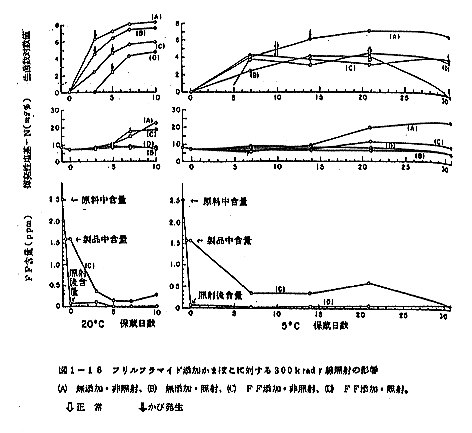 |
結果は図1-18に示すように、照射による揮発性塩基の含量の上に特別の変化は見られなかった。
FFの添加、無添加に拘らず非照射区では塩基性窒素は次第に増加し、照射区ではほぼ一定の値を保った。
 |
FF添加照射区(D)のみが20℃において3日、5℃において約5日菌の増殖が防止され、他の3区では菌の増殖は直ちに進行した。結果は図1-18に示されている。
 |
かまぼこ表面に微生物の発生が肉眼的に認められれば、通常食用には供しない。よって表1-30にはこのような微生物が発生するのに必要な各試験区の所要日数を示した。ソルビン酸添加区では照射の効果は顕著であった。非照射区においても保蔵性は大であった。無添加照射区では効果が低かった。FF添加の効果は見られなかった。
|
肉眼判定によりかまぼこ表面に微生物の発生を認めるに至る所要日数 |
| 保蔵温度 |
無添加 非照射 |
無添加 照 射 |
ソルビン酸添加区 |
FF 添 加 区 |
||
| 2000ppm 非 照 射 |
2000ppm 照 射 |
2.5ppm 非 照 射 |
2.5ppm 照 射 |
|||
| 5 ℃ |
14日 |
31日 |
45 日以上 |
45 日以上 |
14 日 |
31 日 |
| 20 ℃ |
3日 |
5~6日 |
10 日 |
25 日 |
3 日 |
5 日 |
| 照射線量:300krad |
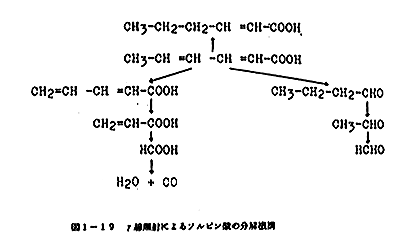
ソルビン酸水溶液を照射し、残存率100、50および20%水溶液のエーテル抽出物について質量分析を行ない、表1-31に示すフラグメントを検出した。これを解釈すれば図1-19に示すような分解機構となり、特に有害性を考慮すべき成分は生成されないものと推定できた。
|
ソルビン酸照射分解物の質量分析にみられるフラグメント |
| m/e フ ラ グ メ ン ト |
ソルビン酸残存率 100% 50% 20% |
| 114 CH3-CH2-CH2-CH=CH-COOH 113 CH3-CH2-CH-CH=CH-COOH 112 CH3-CH=CH-CH=CH-COOH 97 -CH=CH-CH=CH-COOH 71 -CH=CH-COOH-CH2-CH2-CH2-CHO 67 CH3-CH=CH-CH=CH- 57 CH3-CH2-CH2-CH2- 55 CH3-CH=CH-CH2- 45 -COOH 43 CH3-CH2-CH2- -CH2-CHO 41 CH3-CH =CH- 31 -CH2-OH 29 CH3-CH2- -CHO |
W S S S W S S M W S S S S W W W W M W M S M S S S M W M W |
| S=強、 M=中、 W=弱 |
 |
1-1項と同じスケソータラ冷凍すり身を原料とし、かまぼこ研究所で製造した「板付かまぼこ」で次の組成のものを用いた。原料の特級スケソータラ無塩すり身(しょ糖4.0%、ソルビット4.0%、タリンサン0.2%含有)冷凍物を解凍、調味料を加えて擂潰し板付成型したのち90℃40分間蒸煮したものを試料とした。調味料としては、食塩2.7%、デンプン5.0%、卵白8.0%、しょ糖1.0%、MSG1.0%、本みりん2.0%であり、これに核酸系調味料として5’-イノシン酸ナトリウム(IMPと略す)、5’-グアニル酸ナトリウム(GMPと略す)を等量宛含有するものを、かまぼこ全体量の0.1、0.05%になるように添加したものと、無添加の対照とを試料として用いた。
試料のかまぼこ製造後なるべく速やかに24時間以内に入手し、これを名古屋大学Co-60γ線照射装置により室温(20℃)で照射した。線量率 3.6×10・E(4)rad/hrで、照射線量は300kradである。
また、核酸系調味料の水溶液の照射の場合は、パイレックス共栓試験管に入れ精製窒素ガスを15分間通気して脱酸素したのち密栓して照射した。
IMPおよびGMPの試料溶液を同時分析するために各試料溶液1mlをとり混合したのちアンモニア水でpH9とし、Dowex IX8型イオン交換樹脂カラム(HCOOH型:100~200メッシュ 1.2×35cm)を用いてクロマトグラフィを行った。溶出液はIMPの場合0.1Nギ酸、0.6Nギ酸ナトリウム1:1混合液を、GMPの場合は0.2Nギ酸、0.8Nギ酸ナトリウム1:1混合液を用いた。
溶出液は260nmのUVでモニターしながらフラクションコレクターにて分取した。IMP、GMPはIMPが先に流出され両者は明らかに分離される。それぞれのフラクションを集めて定容したものの260nmの吸光度からIMPはε=6800、GMPはε=10800を用いて含量を計算した。
(注)εは同じ試料について同じ緩衝液を用いて予め求めた
数値であって文献値とは多少異なる。
かまぼこ試料20gを細断し、乳鉢でよくすりつぶしてから少量の水約20~30mlに懸濁し60~70℃で30min加熱したのち4,000ppm,10minで遠沈した上澄液をとり、更に残渣を一回同様に処理した。上澄液を合わせたものに10%TCA溶液2ml加え生じた沈澱を遠心(9,000rpm,7min)除去したのち全量を100mlとして抽出液とした。これより40mlをとりアンモニア水でpHを9.0としたのち a)と同様の方法によりイオン交換クロマトグラフィを行ってIMP、GMPを定量した。
ヒポキサンチン、イノシンについてはグアノシンを、またグアニン、グアノシンについてはイノシンを内部標準としてガスクロマトグラフィを行って定量した。試料溶液に内部標準を加え凍結乾燥した後アセトニトリル、BSA,TMCSを加え、窒素置換したのち封管し沸騰湯浴中で1h加熱反応させてシリル化したものをガスクロマトグラフィにより分析した。ガスクロマトグラフィは島津4BM、カラムはOV-17 1.5% on Shimalite を用い、カラム温度は200→300℃ 5℃/minの昇温を行った。インジェクション温度280℃で行った。
IMPおよびGMPを5mM水溶液として無酸素条件下で300krad照射した場合の残存量を液体クロマトグラフィで定量した。なおかまぼこの中は無酸素に近いものとして窒素置換した場合の分解をしらべた。
3回の実験よりえられた結果はつぎのようであった。
残存IMP GMP
4.60mM 4.40mM
(92.11%) (87.35%)
以上の如くIMPでは8%程度、GMPでは13%程度分解しており、GMPの方がやや照射分解されやすいことが判った。なおこの結果がこれら調味料のかまぼこ中での分解率を表すとは考えられない。この水溶液とかまぼこというタンパク質のゲル状物の中での分解率はかなり差があり、後者の方が保護効果により分解程度が少ないものと考えられる。
IMP、GMPの水溶液を無酸素条件で照射した場合、300kradでの分解率はそれぞれ約8%および13%であったが、この場合の主な分解生成物をガスクロマトグラフィにより検索、定量を行った。それらの結果から、IMPよりはイノシン、ヒポキサンチンが、GMPからはグアノシン、グアニンが主要生成物としてえられ、とくにGMPからのグアノシンの生成が著しいことが分った。
IMP、GMP無添加のかまぼこの場合にも材料の魚肉すり身中にIMPが含まれているが、その程度と照射によりこれがどのように変化するかを検討した。結果は下記の如くで、IMPは原料に14.11mg%存在すること、これを300krad照射するとやや増大すること、GMPは全く検出されないことが判った。
非照射 300krad
IMP 14.11mg% 15.42mg%
GMP 検出されず 検出されず
1)0.05%添加区
非照射 300krad
IMP 27.28mg% 33.13mg%
GMP 11.25 12.37
(回収率 50.02% 60.16%)
2)0.1%添加区
非照射 300krad
IMP 38.90mg% 40.77mg%
GMP 23.92 27.68
(回収率 48.71% 53.03%)
以上の結果からIMP、GMPいずれも実測値を比較してみると照射により増えていることが判る。この中にはIMPの場合元来すり身に存在した量と、その照射による増大も含まれていること、及びこれらの値は添加した量から見ると非照射区では50%、照射区では53~60%程度の回収率にすぎなかったことなどから明確な結論はえられなかったが、添加したIMP、GMPのいずれも300kradの照射ではほとんど分解されていないものと考えられる。
日本水産(株)所属の峰島丸が北洋で製造した特級スケソウタラ無塩冷凍すり身(砂糖 4.0%、ソルビット 4.0%、タリンサン 0.2%添加)を主原料とした。[注:タリンサン(商標)はポリリン酸ナトリウム50%、ピロリン酸ナトリウム(無水)50%の混合物] ケーシング詰かまぼこ製造には次の配合割合を採用した。
配合割合
冷凍すりみに対して
食 塩 2.8%
ジャガイモ澱粉 5.0%
水 25.0%
グルタミン酸ナトリウム 1.0%
砂 糖 1.0%
W P 0.05%
本みりん 4.0%
[注:WP(商標)はイノシン酸ナトリウム50%、
グアニル酸ナトリウム50%の混合物]
冷凍すりみをスリミカッターで細断し、すり上り温度を0℃まで室温で解凍する。これを小型擂潰機(70rpm)に投入し、配合割合にしたがって漸次添加して35~40分間擂潰する。すり上り温度は12℃とした。
擂潰終了後、自動結索機を用いアルミワイヤで機械的に一次結索したサランフィルム(塩化ビニルと塩化ビニリデンの共重合体)の折径 60mm - 長さ 260mm に上記すり上り身を充填機で170g充填して、同じく自動結索機で二次結索する。
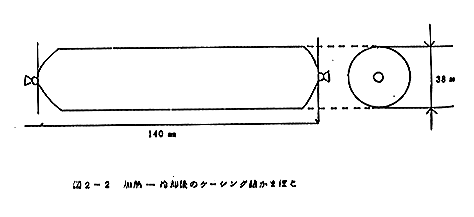
これを85℃の熱水で40分間加熱(図2-1)した後、流水で20分間冷却する。
冷却後のケーシング詰かまぼこ(図2-2)を試料に供した。
 |
 |
300kradの線量でγ線照射処理を行ったのち、10℃および30℃で保存し、照射前後および貯蔵中における弾性、色調、官能的変化を検査し、生菌数の消長を測定する。
作成したケーシング詰かまぼこに東海区水産研究所保蔵部において300kradのγ線照射を行い、照射した試料と非照射の試料をともに10℃及び30℃で貯蔵し、10℃貯蔵は照射直後から7日おきに45日まで、その後は外観から適時測定を行い180日まで測定した。30℃貯蔵は照射直後から毎日測定した。
各測定、検査方法は次のとおりである。
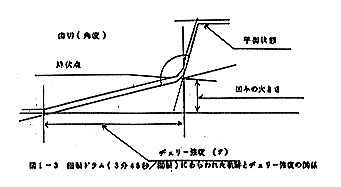
岡田式ヂェリ-強度試験器を使用して、ヂェリ-強度、凹みの大きさ及び歯切を測定した。
直径5mmのブランヂャ-先端を試験かまぼこ片に接触させておき、一定流量の水をブランヂャ-に荷重していくとブランヂャ-は試験片中に押し込まれていき、ついには降伏点に達する。
これに要した水の重量をヂェリ-強度(g),押し込まれた深さを凹みの大きさ(mm)(回転ドラムに軌跡をあらわす関係上、37倍の増殖値となる)、降伏点に達してから平衡状態にもどるまでの時間を歯切(角度)とする。この関係は図1-3に示したとおりである。
ヂェリ-強度の数値は大きいほどよく、凹みの大きさの数値は大きいほどよく、また歯切は数値の小さいほどよい。
 |
弾性(足)の官能検査は、蒲鉾研究所のパネル5名で次の10点法により行った。
1 点 足がない
2 点 〃
3 点 わずかに足が感じられる
4 点 〃
5 点 やや足が感じられる
6 点 足がやや劣るかまぼこ
7 点 足が普通のかまぼこ
8 点 足がよいかまぼこ
9 点 足が非常によいかまぼこ
10点 足が非常によいかまぼこ
日本電色(株)製の色差計を使用して、76.8%の白さを持つ標準板とかまぼこの表面および切断面の白さを比較し、ハンタ-白度とした。この場合、数値の大きい程、白いことになる。
試料からフィルム(ケーシング)を無菌的に除去して、その中央部から滅菌ナイフで5g,輪切にして採取し、これを45mlの滅菌水とともにホモジナイザーでホモジネイトしたものを標準寒天培地で生菌数を、テスオキシコーレイト培地で大腸菌群を培養して調べた。生菌数/gで表示した。
測定及び検査により次の結果が得られた。
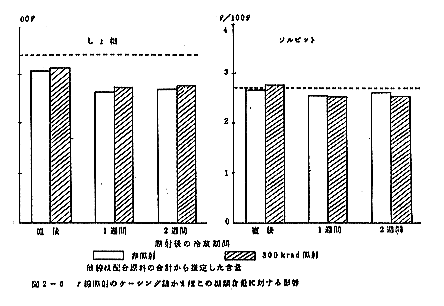
照射直後の測定結果を比較すると、照射試料は非照射試料に対してヂェリ-強度が30gの増加を示し、凹みの大きさ及び歯切は変わらない。この結果は照射試料の品質が良い傾向にあると考えられる。
官能検査においても照射試料は7.5点、非照射試料 7.3点であり、照射試料の品質が良い結果であったことを示しているが、味が淡白な傾向にあった。
この差は貯蔵期間が進むにつれて大きくなり、35日目で照射試料は非照射試料に比較してヂェリ-強度40g、凹みの大きさ2mm増加し、歯切は5゜小さくなり、両者の差が認められる。
官能検査においても照射試料は7.5点、非照射試料は7.0点で同じ結果であった。
また、非照射試料は35日目でかすかな変敗臭が感じられた。
貯蔵の最終日すなわち180日目には照射試料は非照射試料に比較してヂェリ-強度110g、凹みの大きさ7mm増加し、歯切は変らず、照射試料は非照射試料より品質の低下が著しく遅い。
官能検査においても照射試料は7.0点、非照射試料は6.5点と照射試料が良好であった。
照射直後の照射試料は55.4%、非照射試料は51.6%で明らかに照射試料が白く、官能的にも明確に判別できた。
180日貯蔵後においても照射試料は51.6%、非照射試料は47.2%と照射試料が明らかに白い。しかし、両者ともに貯蔵が進むにつれて白度の低下がみられる。
すり身の生菌数は3.5×10・E(5)であり、照射も非照射もこの値は同じである。加熱により生菌数は減少し30以下になる。
照射直後の照射試料および非照射試料はともに30以下であった。照射試料は123日目までは30以下を保っており、180日目で3.4×10・E(3) であった。一方、非照射は28日目で5.0×10・E(4)で、35日目では2.3×10・E(5)で、この35日目より変敗臭が感じられた(試験的に変敗臭を感じても食するが、通常不可食として扱う)。
180日目では2.4×10・E(7)で変敗していた。
以上の結果より照射試料の可食期間は180日以上、非照射試料は28日間と思われる。
大腸菌群はすり身で陽性、加熱後の照射試料及び非照射試料ともに陰性で、180日目においても陰性であった。
照射直後の測定結果を比較すると、照射試料は非照射試料に対し30g、凹みの大きさ2mmの増加を示し、歯切は変わらない。この結果は照射試料の品質が良い傾向にあると考えられる。
官能検査においても照射試料は7.5点、非照射試料7.3点であり、照射試料の品質が良い結果であったことを示しているが、味が淡白な傾向にあった。
照射試料及び非照射試料はともに貯蔵が進むにつれて急速に低下し照射試料は3日目でヂェリ-強度420g,凹みの大きさ35mm,歯切134゜。
非照射試料は2日目でヂェリ-強度420g,凹みの大きさ35mm、歯切134゜、非照射試料は2日目でヂェリ-強度410g,凹みの大きさ32mm、歯切135゜であった。つづいて照射試料5日目及び非照射試料3日目でともに軟化により測定不能となった。
照射直後の照射試料は53.1%、非照射試料は48.5%で明らかに照射試料が白く、官能的にも明確に判別できた。両者ともに貯蔵が進むにつれて白度の低下がみられる。
すり身の生菌数は3.8×10・E(5)であり、照射も非照射もこの値は同じである。加熱により生菌数は減少し30以下になる。
照射直後の照射試料及び非照射試料はともに30以下であった。照射試料は3日目まで可食で 3.5×10・E(3)であり5日目より一部軟化して3.1×10・E(4)となり軟化が進む。一方、非照射は1日目でかすかな変敗を感じ1.6×10・E(5)である、3日目で完全に軟化して 1.2×10・E(7)であった。
大腸菌群はすり身で陽性、加熱後の照射試料及び非照射試料ともに陰性であった。
以上、結果より考察するとケーシング詰かまぼこの照射は非照射に比較して弾性(足)、白さが良くなる。すなわち品質が向上すると思われる。また、可食期間は10℃貯蔵において、照射品は、180日以上で、非照射品は28日までであった。30℃においての照射品は3日、非照射品は1日であった。このように照射は低温(10℃)において保存効果が特に大きいが、高温(30℃)では保存効果が弱い。なお、照射品は照射直後において味が淡白になる傾向があったが、香りの変化は感じられなかった。
2-1に記したケーシング詰かまぼこを京都に直送して試料とした。
京都へ送られた試料を大阪府立放射線中央研究所のCo-60線源を用いて300krad照射した。上記試料を10℃および30℃で貯蔵し、30℃貯蔵区では照射直後(0日)、1日後、3日後、5日後および8日後に、10℃貯蔵区では照射直後(0週)、1週間後、2週間後、3週間後、5週間後に調査測定した。
かまぼこの内部に存在する好気性細菌の生菌数を測定するため、試料かまぼこのケーシングをはがした後、約1cmずつ輪切りにし、それを直径2cmのコルクボーラーで打ち抜いて試料とした。この内部試料約40gをTween 80の0.005%水溶液160mlとともにホモジナイズしその1ml中の生菌数を計数した。
好気性細菌の生菌は肉汁寒天培地(肉エキス5g,ポリペプトン5g,寒天15gを水1lにとかし、pH7.0にしたもの)を用いて混釈平板培養し、形成されるコロニー数を計測した。腐敗の状況は肉眼観察および写真撮影によって判定した。
結果を表2-1に示した。
京都へ直送されてきたケーシング包装かまぼこ中には1.8×10・E(2)/gの好気性細菌が存在するが、300kradの照射によって5/g以下に減少する。非照射の試料を30℃に貯蔵すると生菌数は急速に増加し、3日後には10・E(6)/gのオーダーに達した。8日目の試料ではケーシング中にガスがたまって膨張し、内部に液体が浸透して組織が脆弱になった。これに対してγ線照射した試料では30℃で貯蔵しても8日目では生菌数の増加は全く認められず、5/g以下であり外観もほとんど変化しなかった。
一方、非照射試料を10℃で貯蔵すると、その生菌数の増加速度は30℃貯蔵に比べればかなり遅いが、3週間目で10・E(6)/gのオーダーに達した。これに対して照射試料を10℃で貯蔵すると5週間後でも生菌数の増加および外観の変化が全く認められなかった。
以上の結果からかまぼこを300krad照射した後、30℃で貯蔵した場合少なくとも8日間、10℃で貯蔵した場合少なくとも5週間は生菌数が増加しないことがわかった。
今回の供試材料であるケーシング詰かまぼこでは、2次汚染はほとんど考えられないから、製造にともなう加熱処理で原料中に存在した好気性細菌の大部分が死滅し、さらに生き残った好気性細菌のほとんどがγ線照射によって殺菌されたためにこのような好結果が得られたものと思われる。
|
貯蔵温度10℃ |
| 貯 蔵 日 数 |
0 |
7 |
14 |
21 |
35 |
| 照射試料 (300krad) 非照射試料 |
< 5 1.8× 10・E(2) |
< 5 2.0× 10・E(3) |
< 5 2.3× 10・E(5) |
< 5 1.4× 10・E(6) |
< 5 1.1× 10・E(6) |
| 貯 蔵 日 数 |
0 |
1 |
3 |
5 |
8 |
| 照射試料 (300krad) 非照射試料 |
< 5 1.8× 10・E(2) |
< 5 9.8× 10・E(4) |
< 5 3.8× 10・E(6) |
< 5 7.6× 10・E(6) |
< 5 6.3× 10・E(6) |
| (1g中の生菌数) |
2-1に記したケーシング詰かまぼこを試料として用いた。
製造当日入手した試料を-20℃のフリーザーに貯蔵し、実験の都度室温で解凍後、照射し、貯蔵実験に移した。都立アイソトープ総合研究所のCo-60 γ線照射装置(5kCi)を用い、線量率130krad/hで、試料を回転させ、線量の均一化をはかりながら、300krad照射した。照射後の貯蔵温度を10℃、30℃、及び15℃、20℃とかえた2シリーズの実験を行った。貯蔵後図2-3に示すような貯蔵日に、それぞれ試料を取り出し、中央部を1cm厚輪切りに切り出し、細刻し、混合、その5gを秤取、滅菌嫌気性菌用稀釈水20mlを加え、ブレンダーでホモジネートとし、滅菌ガーゼでロ過、ロ液またはその適当な稀釈液の一定量を、炭酸ガス噴射下、試験管中の溶融VL変法培地に注下し、密栓後ロールチューブ法で、また、一部試料についてはBHI寒天培地平板上に塗抹し、スチールウール法で嫌気培養した。いずれも30℃、48時間培養後にあらわれるコロニーを計数し、嫌気性菌数とした。試料の採取部位による違いをみるため、中央部のほか、結索側端部を切り出し、同様の操作を行った。また、一部チューブは7℃10日間の培養を行い、あらわれるコロニー数を以て低温菌数とした。このほか、10℃及び30℃の貯蔵実験において、常法により一般生菌数を求め、好気性菌数とした。菌数計測の際えられた、代表的な形状、色沢などを示すコロニーから釣菌し、菌の同定を行った。
 |
図2-3に貯蔵中のかまぼこにおける菌数の変化を示した。図から300krad照射しても、30℃というように貯蔵温度が高いと、菌数からいって僅かな貯蔵期間の延長効果しか認められず、それより低温で照射による貯蔵期間の延長効果が著しいことがわかる。しかし、10℃といったような低温では、この実験の貯蔵期間の範囲内では照射、非照射にかかわりなく、低温の貯蔵効果が著しく、照射による効果を明らかにしえなかった。低温菌数の測定を行ったが、その存在、貯蔵中の増加とも、中温菌(30℃培養後のコロニー数)にくらべ問題にならないレベルであって、そのことが低温の貯蔵延長効果が著しかった原因の一つと考えられる。
表2-2に30℃の貯蔵実験の結果の一部を示したが、表からわかるように、試料採取部位による菌数の差はそれほど著しくなかった。また、ロールチューブ法の方がスチールウール法にくらべ、より嫌気条件がきびしいといわれるが、表からわかるように、両培養法による嫌気性菌数に差はなく、偏製嫌気性菌数もスチールウール法で十分計数しうることがわかった。
表2-3に性状検査の結果を示した。また、表2-4にその分離源を示したが、照射による嫌気性菌のミクロフローラの変化はあまり明瞭ではない。むしろ、貯蔵の初期において球菌をまじえたミクロフローラが、貯蔵の進むに従って嫌気性桿菌の、それもClostridiaが優勢になることがわかった。
| 処 理 部 門 |
培* 養 法 |
貯 蔵 (日) |
||||
| 0 |
1 |
2 |
8 |
|||
| 非 照 射 |
中 央 部 |
RT SW |
1.3× 10・E(2) |
2.3× 10・E(6) |
2.9×10・E(7) 3~3.5×10・E(7) |
5×10・E(5) 6.3×10・E(6) |
| 端 部 |
RT SW |
3.8× 10・E(2) |
2.5× 10・E(6) |
1.5~ 2×10・E(7) 2.9~3.8×10・E(7) |
5×10・E(6) 2.5×10・E(6) |
|
| 300krad 照 射 |
中 央 部 |
RT SW |
3.8×10 |
7.5× 10・E(2) |
1.3×10・E(3) 6.3×10・E(3) |
3~4.1×10・E(7) 1.3~1.4×10・E(7) |
| 端 部 |
RT SW |
1.3×10 3.8×10 |
3× 10・E(3) |
3.5×10・E(4) 3.5~5×10・E(4) |
5.7~8.8×10・E(6) 7×10・E(6) |
|
| *) RT:ロールチューブ法、 SW:スチールウール法 |
| |
斜 面 上 の 発 育 |
グ ラ ム 染 色 性 |
ガ ス 発 生 |
牛 乳 培 地 の 変 化 *) |
ゼ ラ チ ン 消 化 |
酸 生 成 |
硝 酸 塩 還 元 |
イ ン ド | ル 産 生 |
硫 化 水 素 産 生 |
卵 黄 反 応 |
真 珠 層 形 成 |
***) 該当すると考えられる 菌 種 |
|||||||
| グ ル コ | ス |
サ ッ カ ロ | ス |
マ ル ト | ス |
ラ ク ト | ス |
ス タ | チ |
グ リ セ リ ン |
サ リ シ ン |
マ ン ニ ッ ト |
||||||||||||
| 桿菌 I II III IV V VI |
- ++ ++ ++ ++ ++ |
± ± + + + + |
- - - + + + |
- C C St CD - |
- + + + + + |
- + + + + - |
- + - + - - |
- + - + + - |
- - - + + - |
- - - + - - |
- - ± + ± - |
- - - - - - |
- - - - - - |
- + + - - - |
- - - - - + |
- - - ++ + + |
- - - + + - |
- - - - + - |
Bacteroides Eubacterium foedaus Corynebacterium sp. Clostridium perfringens Cl.sporogenes Cl.lentoputre- scens |
| 球菌 I II III |
+ + + |
+ + + |
- - - |
C C - |
+ + - |
+ + + |
+ + + |
± - + |
- + - |
- - - |
- - - |
- - - |
- - - |
+ + - |
- - - |
- - - |
- NT NT |
- ** NT NT |
Peptostreptoco- ccus evolutus Peptostreptoco- ccus intermedius Staphylococcus saccharolyti- cus |
| *) C:coagulate, D:digest, St:stormy fermentation **) NT:not tested ***)総供試分離株数 82 (嫌気性非芽胞桿菌 50、有芽胞桿菌 20、 球菌 12) |
| |
|
30 ℃ に お け る 貯 蔵 (日) |
||||||||
| 0 |
1 |
2 |
3 |
5 |
8 |
|||||
| 非照射 照 射 |
中央部 端 部 |
桿菌II、球菌I |
桿菌I 球菌II |
桿菌I 桿菌I |
桿菌I 桿菌II、球菌III |
桿菌IV 桿菌IV |
桿菌I、V |
|||
| 中央部 端 部 |
球菌I 桿菌I、球菌I |
桿菌I 桿菌I |
桿菌I、III 桿菌I |
|
桿菌I |
桿菌I、V 桿菌I、V |
||||
| |
|
10 ℃ に お け る 貯 蔵 (週) |
||||||||
| 2 |
3 |
5 |
6 |
|||||||
| 非照射 照 射 |
中央部 端 部 |
|
球菌I |
桿菌I 桿菌II、VI |
桿菌I |
|||||
| 中央部 端 部 |
桿菌III |
|
桿菌III |
|
||||||
 |
2-1に記したケーシング詰かまぼこを試料として用いた。
蒲鉾研究所で調製したケーシング詰かまぼこを空輸、低温室(4℃)に一夜放置後、室温で、300krad照射[線量率4.83×10・E(4)rad/h]した。照射直後の官能検査は訓練されていないパネルによる3点比較法と嗜好テストを行った。揮発性成分の測定は次のように行った。非照射および照射(300krad)試料は10℃および30℃で保存した。10℃保存の場合には照射直後、1、2、3、及び4週間後に揮発性成分の測定を行い、30℃保存の場合は、照射直後、1、2、3、4、5、6及び7日後にそれぞれ揮発性成分の測定を行った。揮発性成分の測定はかまぼこ300gに水200mlを加え、ミキサで1分間磨砕し、600ml容試薬瓶に入れてシリコンゴム栓をした。注射器で脱気(50ml)を行った後、湯浴中(98℃)で30分間加熱し、10秒間振った後、head space vapor 10mlを取り、ガスクロマトグラフィ(GLC)により分析した。装置は日立K-53形ガスクロマトグラフを用い、カラムには最も分離のよかった20%PEG400(担体:2N NaOH処理celite,60~80メッシュ)、2m×3mmidを主として用いた。さらに揮発性成分の同定のために試料3×300gより同様に処理してhead space vapor 10mlずつ20~30回取り、カラム(2m×3mmid)の中央部20cmをドライアイス・エタノール浴で冷却したGC-MS(GC:日立K-53形、MS:日立RMS-4形)、に注入した。次いでドライアイス・エタノール浴を除き、カラム温度を80℃まで昇温(3℃/min)して各ピークのマススペクトルを測定した。さらに標品と保持時間の比較などからピークの同定を行った。
官能検査の結果は次の通りである。2回行ったが、1回目、識別総数11、正解数4、2回目、識別総数13、正解数4から、2回とも3点比較法限界値より照射の有無による差は認識されないという結果が得られ、また嗜好テストにおいても識別正解数が少なく、両者の差も少ないことからどちらが好ましいとも言えない。なお、総数では延べ24名中13名がどうともいえないとしている。照射後10℃保存の場合には4週間後においても照射、非照射両試料とも官能的にはそれほど変化が見られなかった。一方、30℃保存の場合には、非照射のものは2日後既に腐敗臭が感ぜられ、300krad照射の試料でも5日後には腐敗臭が感ぜられた。
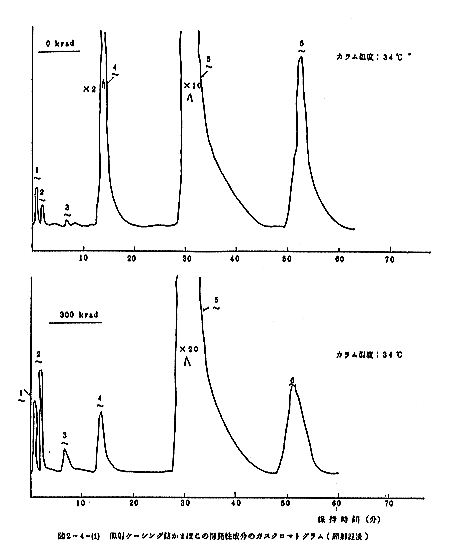
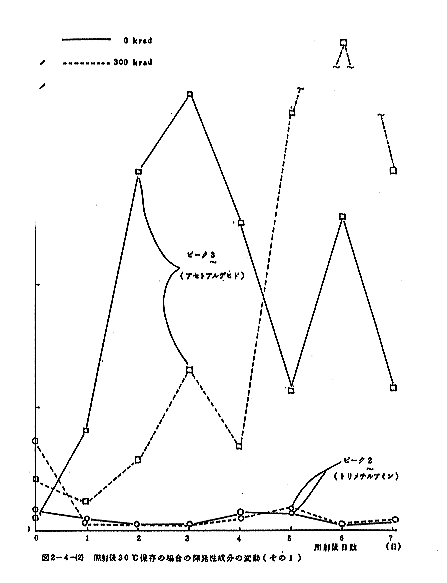
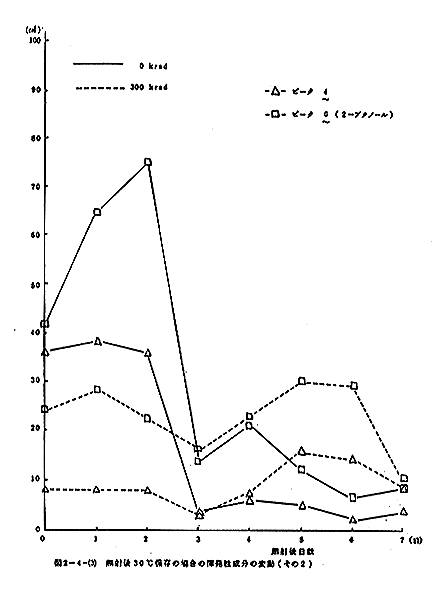
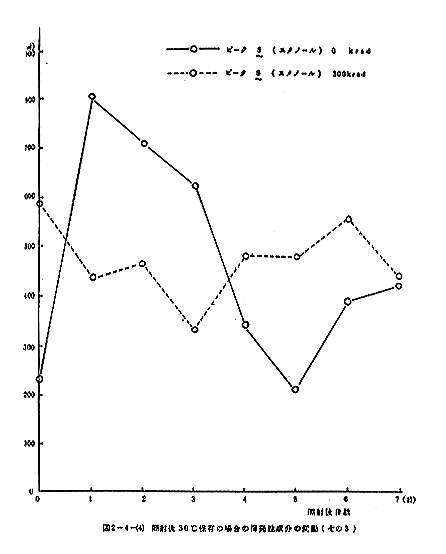
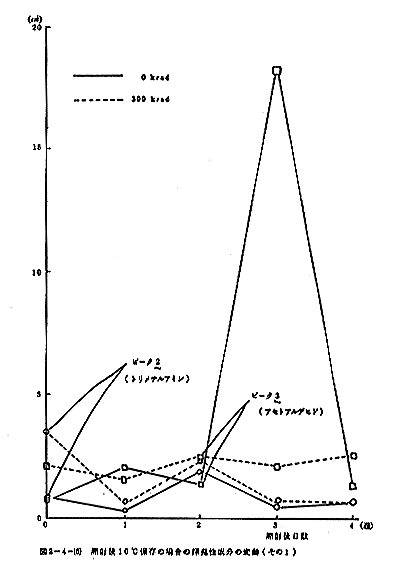
揮発性成分のGLCによる測定結果を図2-4-(1)に示す。なお、ガスクロマトグラフの操作条件は次のとおりである。Oven temp:30℃、injection temp:130℃、N2(carrier gas):0.6kg/cm3、air:1.0kg/cm3、H2:1.0kg/cm3、attenuation:ピーク1、2はトリメチルアミン、3はアセトアルデヒド、5はエタノールと同定された。ピーク6は2ブタノールにアミンが混在している可能性がある。照射することによりピーク1、2(トリメチルアミン)、3(アセトアルデヒド)のようなより揮発性の成分とピーク5(エタノール)の増加が認められたが、ピーク4(未知物質)と6はかえって減少した。
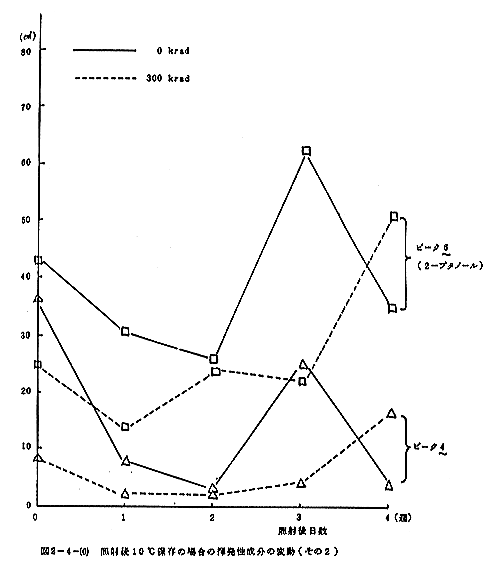
照射後30℃に保存した場合における揮発性成分の変動を図2-4-(2)~(4)に示す。トリメチルアミンは照射直後増加するが、以後減少して非照射との差が認められなくなる。アセトアルデヒドも照射によりやや増加するが、以後両者とも増加する傾向にあった。ピーク4と6はどちらも照射によって顕著に減少し、以後大きな変動は見られないが、非照射の試料では一旦増加するが、以後減少して照射試料との差が認められなくなる。エタノールは照射によって顕著に増加するが、以後非照射試料との差は減少する。
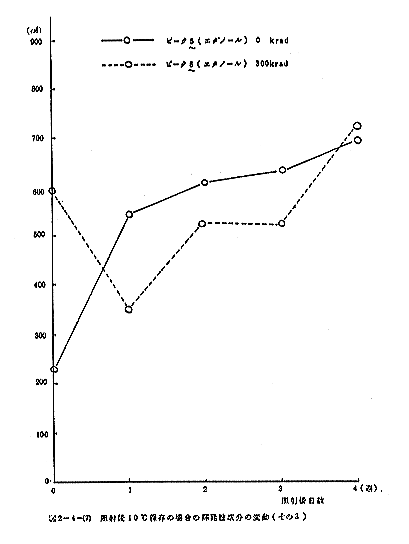
照射後10℃に保存した場合における揮発性成分の変動を図2-4-(5)~(7)に示す。トリメチルアミンは照射直後増加するが、以後減少して非照射との差が認められなくなる。アセトアルデヒドも照射によりやや増加するが、以後一部の例外を除いて余り変動が見られない。ピーク4と6はどちらも照射によって顕著に減少するが、以後非照射との差が小さくなる傾向にあった。エタノールは照射により顕著に増加するが、以後両者の差は小さくなり、両者とも量は激増する傾向にあった。
 |
 |
 |
 |
 |
 |
 |
2-1に記したケーシング詰かまぼこを試料ととして用いた。
全窒素はミクロ・ケルダール法で、蛋白質はIrazhki および Gill らのミクロ・ビュレット法で310mmの波長を用いて定量した。標準蛋白質としては Bovine serum albumin(NBC社製)を用いた。蛋白質の抽出溶媒には、奥田、Stravらによって魚類、筋肉蛋白質を抽出する際に用いられた溶媒を準用し、次の物を用いた。
1) 水
2) 10%NaCl
3) 0.2%KOH
4) 70%アルコール
5) 塩化カリー燐酸混液(0.3MKC1、0.15M燐酸カ
リをふくむ溶液をKOHでpH6.5に調製したもの)
6) 5)の溶液にKSCNを5%になるように溶解させた溶液
7) 5)の溶液にKSCNを10%になるように溶解させた溶
液
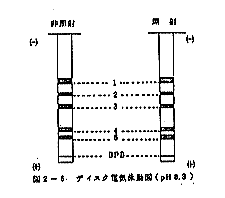
ケーシング詰かまぼこからの各種溶媒による蛋白質の抽出方法は、包丁で細断したかまぼこ1g(wet weight)に対して溶媒100mlを加え、ホモジナイザー(氷冷中)で正確に5分間均質化し、5℃で10,000rpm、10分間遠心した上澄液を蛋白質の試料とした。抽出した蛋白質の電気泳動的性質の分布を検討するために永井の方法に準じてディスク電気泳動を行った。すなわち、分離用ゲル7.5%、濃縮用ゲル2.5%とし、pH8.3(トリスーグリシン)緩衝液で1tubeあたり3mAの定電流で50分間泳動させた後、アミノブラック10Bで染色した。試料の調製は溶液0.15mlあたり、600μgになるように溶解させ、濃縮用ゲルの上に静かに注入した。
超遠心分析は照射および非照射ケーシング詰かまぼこから0.2%KOH溶媒で抽出した蛋白質溶液を0.2%KOH溶液に対して十分に透析(24時間、5℃)したものを試料とし、最高回転数56,200~56,700rpmで4分おきに沈降図形を撮影した。
ケーシング詰かまぼこから蛋白質をできるだけ高収量で抽出するために各種溶媒で蛋白質の抽出を検討した結果が表2-5である。抽出率は昨年の実験結果から0.2%KOHの溶媒で完全に蛋白質が抽出されることがわかっているのでこれを100%として、他の溶媒の抽出率を算出した。この表からあきらかなように、0.2%KOHについで70%アルコールの溶媒による抽出率は99.5%と最も高く、水、10%NaCl、塩化カリ-燐酸混液、5%、10%のKSCNをふくむ塩化カリ-塩酸混液による蛋白質の抽出率は70~90%であった。一方、照射したケーシング詰かまぼこからの0.2%KOH、70%アルコールの溶媒による蛋白質の抽出率はそれぞれ96%、94.5%であった。その他の溶媒による蛋白質の抽出率は70~90%であった。このことは照射前後のケーシング詰かまぼこからの抽出率にはほとんど差がなく、蛋白としての溶解性からは変化が認められないと判断された。
| 溶 媒 |
蛋白質の抽出率(%)* |
|
| 非照射 |
照 射 |
|
| 水 10% NaCl 0.2%KOH(pH 12.4) 70% アルコール 塩化カリ - 燐酸混液 (pH 6.5) 5% KSCN(塩化カリ-燐酸混液) 10% KSCN( 〃 ) |
70.5 76.4 100 99.5 88.7 88.3 85.9 |
70.3 76.0 96.0 94.5 90.1 84.8 82.7 |
| * 0.2%KOHの溶媒で蛋白質が完全に溶出されることから、これを 100%として、他の溶媒の抽出率を算出した。(ピュレット法) |
照射前後のケーシング詰かまぼこから0.2%KOH、溶媒を用いて抽出した蛋白質をディスク電気泳動的に比較検討した結果が図2-5である。泳動時の試料は希塩酸でpH8.8に調製し、サッカロースを加えて電気泳動を行った。図に示されるように照射、非照射のケーシング詰かまぼこから抽出した蛋白質はいずれもpH8.3で5本のバンドにわかれ、同じ易動度を示した。このことはCo-60γ線で300krad照射してもケーシング詰かまぼこ蛋白質は電気的にほとんど変化がないものとみなされる。
 |
照射と非照射のケーシング詰かまぼこから0.2%KOHで抽出した蛋白質溶液の沈降図を比較検討した。0.2%KOHで抽出した蛋白質溶液を56,200~56,700rpmで20分後を求めたところ、非照射、照射蛋白質はともに単一なピークを示し、沈降定数はそれぞれ2.58S、2.78Sであった。このように沈降定数からもほとんど変化がみられない。
以上総合すると、照射前後のケーシング詰かまぼこ蛋白質としての物理化学的性状には大きな変化がみられないと結論された。
2-1に記したケーシング詰かまぼこを試料として用いた。
ケーシング詰かまぼこを300krad、Co-60γ線照射を行い、未照射とともに10℃および30℃で保存し、10℃については3日後、1、2、3、4週間後に、30℃については毎日官能的に観察して、10℃について4週間後のものを、30℃については未照射で2日後、照射で3日後のものをアミノ酸分析の試料とした。遊離アミノ酸は80%エタノールと磨砕抽出し、エタノールを溜去して、アミノ酸アナライザーで分析した。
照射直後のものは、魚くささが強くなった。10℃保存では4週間目でも照射、未照射ともに劣化は認められなかったが、照射試料の魚くささも消えなかった。30℃保存では未照射試料で3日目、照射試料で4日目にネトが発生したが、においは悪くなっていない。また魚くささの照射による増加も消えなかった。アミノ酸分析は、10℃では最も長く保存したもの、すなわち4週間目のものを、30℃保存では劣化直前のもの、未照射では2日目、照射では3日目のものを用いた。アミノ酸アナライザーによっているのでトリプトファンは分析されていないが、プロリンも、試料が、添加された多量のグルタミン酸を含むために分析することができなかった。結果は表2-6にあるとおりである。
この表を見ると、照射前後及び保存前後の各アミノ酸含量は完全に一致しているとはいえない。しかし、グルタミン酸について、アナライザーの再現性を見ると、同一試料について±4%、異なる同一処理試料について、±10%以上のバラツキがあったので、この表の数値のふれを照射およびその後の保存の効果によるとは判定できなかった。また添加されているグルタミン酸を除けば、遊離アミノ酸は一般的に低いので、それらの、この表の程度の変動はそれほど重要とは考えられない。昨年の冷凍すり身では変動が少なかったが、これはかまぼこ成形にともなう変動因が加わったものと考えられる。また、冷凍すり身でグルタミン酸の照射による増加が観察されたが、今回は添加されたグルタミン酸が圧倒的に多いので、これにかくされて、グルタミン酸の変動は観察できなかった。
| アミノ酸 |
未照射 直 後 |
照 射 直 後 |
未照射 10℃ 4週間 |
照 射 10℃ 4週間 |
未照射 30℃ 2 日 |
照 射 30℃ 3 日 |
| Lys His NH3 Arg Asp Thr Ser Glu Pro Gly Ala 1/2Cys Val Met Ile Leu Tyr Phe |
0.36 0.15 2.25 0.12 0.03 0.07 0.09 30.5 - 0.28 0.34 0.03 0.08 0.05 0.05 0.07 0.04 0.04 |
0.29 0.12 1.97 0.09 0.02 0.07 0.08 25.3 - 0.23 0.30 0.01 0.07 0.03 0.04 0.07 0.03 0.03 |
0.37 0.22 1.80 0.24 0.02 0.06 0.10 25.3 - 0.20 0.26 0.01 0.05 0.04 0.03 0.06 0.03 0.04 |
0.28 0.11 1.60 0.09 0.03 0.06 0.08 21.4 - 0.02 0.27 0.01 0.06 0.05 0.04 0.06 0.03 0.04 |
0.28 0.11 1.84 0.09 0.04 0.08 0.09 28.2 - 0.30 0.36 0.03 0.08 0.05 0.04 0.08 0.04 0.05 |
0.32 0.12 1.81 0.07 0.03 0.08 0.09 21.4 - 0.20 0.25 0.01 0.06 0.04 0.04 0.06 0.02 0.03 |
| (数字はμmoles/g) |
2-1に記したケーシング詰かまぼこを試料として用いた。
試料のかまぼこは製造後なるべく速やかに入手(24時間以内)し、これを名古屋大学Co-60γ線照射装置により室温(20℃)で照射した。照射線量は300krad、線量率5.7×10・E(5)rad/hである。試料中の糖類の分析は次のように行った。
試料かまぼこの両端を除いて細切りしたものから無作為に集めたものの10gに対し蒸留水30mlを加えホモブレンダーで2.5分間かけてホモジネートを作り、60℃で30分間放置した。このものを6,000rpm10分間の遠心分離により上澄液と沈澱に分け、この沈澱部分はさらに水30mlを加えて攪拌放置後遠心分離を行う操作を2度繰り返して抽出を完全に行った。これらの上澄液を合わせて100ml定容とし抽出液とする。
抽出後1mlにガスクロマトグラフィの内部標準としてイノシット水溶液(2mg/ml)を1ml加えて凍結乾燥を行ったものをTMS化してガスクロマトグラフィを行い内部標準に対する面積比から求めた検量線からしょ糖及びソルビットの定量を行った。
ガスクロマトグラフィの条件は、乾燥試料を無水ビリジンに溶かし、Hexamethyl disilazane(HMDS)Trimethylchlorosilane(TMCS)を加えて70℃10分間加熱しTMS化したものを試料とした。これを日立K53型ガスクロマトグラフFID付、ステンレスカラム2mにSE52、3% on chromosorb W を充填したものを用い、カラム温度200℃ isothermal ついで300℃まで4℃/minで昇温、Injection 280℃、N2 1.0kg/cm3、H20.7kg/cm3、Air 1.5kg/cm3の条件で行った。
前記条件においてγ線照射したものと、非照射のものとについて、照射直後、照射後5℃に1週間、2週間貯蔵したものについて、しょ糖、ソルビットの定量をガスクロマトグラフィにより行った結果を図2-6に示した。
照射直後の値を比較すると、しょ糖、ソルビットともに300kradの照射による量的な変化は全く認められなかった。照射後1週間、2週間低温に保存したものについても照射の影響は全く認められなかった。
 |
2-1に記したケーシング詰かまぼこを試料として用いた。この中には、5’-IMPNa2 および 5’-GMPNaが、すり身1kgに対し、各0.25gが添加されている。
当日製造のケーシング詰かまぼこに29.5krad/hの線量率で300kradを照射した後、かまぼこ中央部を約4cmの厚さに輪切りにし、その30gを6%過塩素酸270mlとともにミキサーに5分間かけ、これをろ過し、ろ液を得た。このろ液100mlを、300mg武田製核酸分離用活性炭カラム0.6cm×6cm に通し、水20mlで洗い、リボーズリン酸および無機リン酸を通過液中に集めた。次に2.8%アンモニア水と98%エタノール(1:1)混合液30mlを徐々に通し、ヌクレオチド、ヌクレオシドおよび塩基類を溶出させた。溶出液は減圧乾固してアンモニアおよびエタノールを除いた。乾固した試料に水25mlを加えて溶解し、試料液とした。試料液の1mlをとり、0.2mlの武田製5’-ヌクレオチダーゼ溶液を加えて37℃に60分加温した。その後 0.8mlの60%過塩素酸および0.2mlの5%モリブデン酸アンモンを加え、さらにFiske-Subbaraw 試薬 0.2mlを加え、100℃に10分間加熱して発色させ、波長830mμにおける吸光度の測定により、ヌクレチオドの5’-リン酸を定量した。これによりかまぼこ中の5’-IMP 及び 5’-GMP の総残存量を求めた。
次に試料液10mlをとり、0.1ml前後の濃アンモニア水を加えてpHを11となし、その5mlを Dowex 1×8、200~400メッシュのギ酸型樹脂カラム 0.7cm×4.8cm に通した後、5mlの水を通してカラムを洗浄した。最初このカラムに0.5ml/minの流量で 0.1Mギ酸(pH 2.5)を100ml流し、塩基類、ヌクレオシドを分取し、続いて0.1Mギ酸 + 0.05Mギ酸ナトリウム溶液(pH 3.4)100mlを用い、同じ流量で流し、各10mlずつを分取してGMP区分を集めた。各分取液の260mμにおける紫外吸光度を測定し、各区分の総吸光度からIMPおよびGMP含量を求めた。また、先に求めた5’-IMP および 5’-GMP の含量とE260値から求めたIMP および GMP量の合計値を比較し、3’-,2’-IMP および 3’-,2’-GMP の生成の有無に検討を加えた。
また、ケーシングかまぼこ中の5’-IMP および 5’-GMP 含量と同じ含量の5’-IMP、5’-GMPの水溶液をつくり、300kradを照射し、破壊状況を見た。
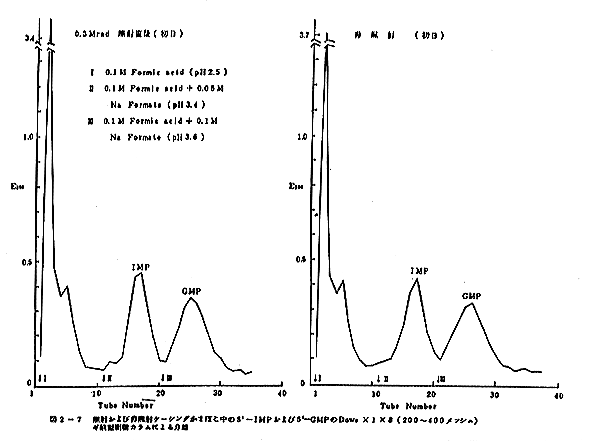
照射及び非照射ケーシングかまぼこ中の5’-IMP および 5’-GMPのDowexギ酸型樹脂カラムによる分離状況を図2-7に示した。IMP区分およびGMP区分は明瞭に分離した。照射かまぼこも、非照射かまぼこもほとんど変わらぬ分離状況を示した。この分離状況は、保蔵日数が経過しても、ほとんど同じであった。E260値と5’-リン酸の測定値から求めたIPMとGMPの量は一致し、かまぼこ中では5’-リン酸の3’-、および2’-位への転移は起こらないことが判明した。よって、かまぼこ中の5’-IMP および 5’-GMPの含量はE260値から求めた。このようにして求めたかまぼこ中の5’-IMP および5’-GMP の照射前後および保蔵期間中の含量変化は表2-7に示した。
この表から、照射前の5’-IMP および 5’-GMP の含量は、それぞれ0.267μmol/g および 0.431μmol/g であり、照射後は0.266μmol/g および 0.428μmol/g となり、残存率はそれぞれ100%および99%であることがわかった。
同濃度水溶液に同線量を照射した時の変化は表2-8に示すように、5’-IMPの残存率は27.5%であり、3’-,2’-IMPの生成量は26.6%、リボーズリン酸の生成量は22.8%、また無機リン酸生成量は12.1%であった。不明物質のリン酸は11.0%であった。5’-GMPの残存率は36.2%であり、3’-,2’-GMPの生成量は28.0%、リボーズリン酸の生成量は16.4%,無機リン酸生成量は8.5%であった。不明リン酸化合物は10.9%であった。
これらの結果と比較すると、かまぼこ中の5’-IMPおよび5’-GMPは強く保護されており、リボーズと5’-リン酸の結合およびヒポキサンチンとリボーズリン酸の結合、あるいはグアニンとリボーズリン酸の結合は300krad程度のγ線によっては切断されないですむことが明白である。
30℃の保蔵試験では3日目に非照射かまぼこは腐敗し始めたが、5’-IMPおよび5’-GMPの含量はそれぞれ103%および96%を示し、含量の低下は無視し得るものであった。しかし7日目には両者ともに86%の含量に低下した。照射かまぼこは7日目に腐敗が始まり、含量はそれぞれ101%および96%であった。これらの結果から、30℃の保蔵期間中、5’-IMPも5’-GMPも著しく含量が低下しないことが明かである。
10℃の保蔵試験では、30日目に非照射かまぼこに腐敗が始まり、5’-IMPおよび5’-IMPの含量はそれぞれ135%および89%となった。照射かまぼこでは30日目でも腐敗せず、5’-IMPおよび5’-GMPの含量はそれぞれ118%および95%であった。10℃では、腐敗に先行して5’-IMPの含量が増大する傾向が認められ、筋肉中のATPが腐敗菌の初期繁殖によって、ATP-ADP-AMP-5’-IMP の一連の変化を受けて、5’-IMPが蓄積するものと推測された。30℃ではこの増大の傾向は僅かに認められ、5’-IMP-ヒポキサンチン-キサンチンの反応がすみやかであり5’-IMPはそれほど蓄積しないものと考えられる。
|
ケーシング詰かまぼこ中の 5’-IMP および 5’-GMPのγ線照射前後並びに保蔵中における含量変化 1.保蔵温度 30℃ |
| |
保 蔵 日 数 |
|||||||||
| 0日 |
1日 |
2日 |
3日 |
5日 |
7日 |
|||||
| 5’ | G M P |
非照射区 |
μmol/g |
0.267 |
0.259 |
0.214 |
0.255* |
0.207* |
0.230* |
||
| % |
100 |
97 |
80 |
96 |
78 |
86 |
||||
| 照射区 |
μmol/g |
0.266 |
0.220 |
0.234 |
0.260 |
0.212 |
0.255* |
|||
| % |
100 |
83 |
88 |
98 |
80 |
96 |
||||
| 5’ | I M P |
非照射区 |
μmol/g |
0.431 |
0.432 |
0.367 |
0.443* |
0.374* |
0.372* |
||
| % |
100 |
100 |
85 |
103 |
87 |
86 |
||||
| 照射区 |
μmol/g |
0.428 |
0.382 |
0.371 |
0.441 |
0.420 |
0.434* |
|||
| % |
99 |
87 |
86 |
102 |
87 |
101 |
||||
| |
保 蔵 日 数 |
|||||||||
| 0日 |
7日 |
11日 |
20日 |
30日 |
||||||
| 5’ | G M P |
非照射区 |
μmol/g |
0.267 |
0.232 |
0.245 |
0.248 |
0.238* |
|||
| % |
100 |
87 |
92 |
93 |
89 |
|||||
| 照射区 |
μmol/g |
0.266 |
0.245 |
0.253 |
0.258 |
0.254 |
||||
| % |
100 |
92 |
95 |
97 |
95 |
|||||
| 5’ | I M P |
非照射区 |
μmol/g |
0.431 |
0.414 |
0.434 |
0.405 |
0.581* |
|||
| % |
100 |
96 |
101 |
94 |
135 |
|||||
| 照射区 |
μmol/g |
0.428 |
0.445 |
0.433 |
0.427 |
0.508 |
||||
| % |
99 |
103 |
100 |
99 |
118 |
|||||
|
300kradのγ線照射による5’-GMP および 5’-IMPの破壊状況 |
| |
ヌクレソチ ド全リン酸 |
5’-ヌクレオ チドリン酸 |
3’-、2’-ヌ クレオチドリン酸 |
リボーズ リン酸 |
無 機 リン酸 |
その他 リン酸 |
||
| 5’-GMP |
照射区 |
μmol/g |
0.310 |
0.175 |
0.135 |
0.079 |
0.041 |
0.053 |
| 非照射区 |
μmol/g |
0.483 |
0.475 |
0 |
0 |
0 |
0.008 |
|
| 5’-IMP |
照射区 |
μmol/g |
0.303 |
0.154 |
0.149 |
0.128 |
0.068 |
0.062 |
| 非照射区 |
μmol/g |
0.561 |
0.555 |
0 |
0 |
0 |
0.006 |
|
 |
全国かまぼこ水産加工業協同組合連合会かまぼこ研究所に冷凍保蔵した特級スケソータラ無塩冷凍すり身(北洋産、日本水産峰島丸調製、プラスチック包装10kg詰)を使用した。
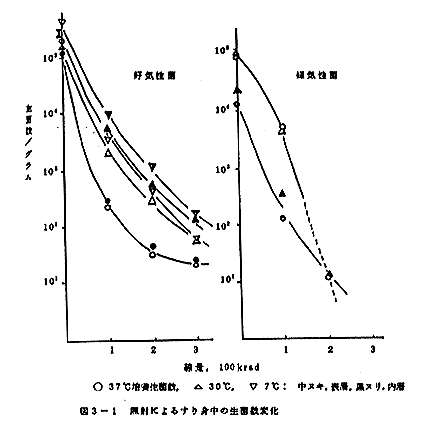
すり身を約6℃の冷蔵室に一夜放置し解凍した。その辺縁部を除き、約5cm立方のブロックを切り出し、表面に沿ってナイフを入れ4層とし、上下2層の表層、残り2層の内層にわけ、滅菌プラスチックシャーレに容れ、回転照射台を用い、Co-60γ線を300krad照射した。また、線量効果を明らかにするために、別に100および200krad照射した。照射後、試料を細切りし、4倍量の嫌気性菌用稀釈水を加えてブレンダーにかけ、ホモジネートし、その原液、または適当に稀釈したその1mlの好気性菌にあっては、約15mlの溶融標準寒天培地に混釈し、平板とした。また、嫌気性菌にあっては、0.2mlの試料液をCO2噴射下、約9mlの溶融VL変法培地に混釈、ブチルゴム栓を施して氷水中ロールチューブ法で固化した。これら平板、あるいは試験管を37℃および30℃培養し、48時間後に現れるコロニーを計数した。また、一部は7℃で培養し、10日後に現れるコロニー数を以て好冷菌数とした。これら計数の際えられたコロニーのうち、形状、色沢の異なるものをえらんで釣菌し、その性状をしらべ、グループ分けした。
すり身の生菌数に対する線量効果を図3-1に示す。好気性菌の生存曲線は凹みを持ち、感受性の異なるミクロフローラよりなることを示し、300kradの照射でもなお生菌が認められるが、嫌気性菌では300kradではコロニーの発現を認めず、また、生存曲線の傾向からいっても、この線量で完全に殺滅されたものと見積もられる。好気性菌では、好冷菌が中温菌より多く見いだされたが、嫌気性菌では全く好冷菌を見出せなかった。これらコロニーより釣菌した分離株の性状検査の結果の一部を表3-1、表3-2に示す。釣菌にあたって、同様の形状、色沢を示すコロニー数を別に記録したが、その結果を表3-3にまとめる。好気性菌において Pseudomonas 優勢のフローラが、照射により Micrococcus 優勢にシフトすることがわかるが、線量の増加により酵母の分離頻度もふえてくる。嫌気性菌においては、球菌、桿菌の混合フローラは、照射により球菌がやや優勢になるように思われる。
| 微 生 物 |
性 状 群 |
運 動 性 |
カ タ ラ | ゼ |
オ キ シ ダ | ゼ |
ブの ド酸 ウ生 糖成 よ り |
O-F テ ス ト |
ガ ス 産 生 |
pH |
ゼ ラ チ ン 分 解 |
V-P 反 応 |
硝 酸 塩 還 元 |
ク エ ン 酸 利 用 |
尿 素 分 解 |
硫 化 水 素 産 生 |
無 機 N 利 用 性 |
分 離 株 数 |
||
| グラム陰性 桿 菌 |
I II III IV V VI VII VIII |
+ + + + - - - - |
+ + + + + + + + |
+ + - - + + + + |
+ + + + - - - + |
F F F F F |
+ + + + - - - - |
4.3~5.4 5.4~5.8 4.2 4.2 4.8 5.8 5.0~5.2 5.6 |
+ - - - - - + + |
+ + - - - - - - |
+ + + + - - + - |
+ + + - - - - - |
- - - - + - + - |
+ - + - - - - - |
+ + + + - - + + |
16 11 1 1 2 1 2 1 |
35 |
121 |
| グラム陽性 球 菌 |
I II III IV V VI VII VIII IX X |
- - + + - - - - - - |
+ + + + + + + + + + |
+ + + + - - + + + - |
- - - + + + - - + + |
F F F F F |
- - - - - - - - - - |
6.4 6.4 6.2~6.4 4.6~4.8 4.4 4.6 5.6 7.4 5.2 4.4~4.6 |
- - - + - + + - + + |
- - - - - - - - - + |
+ + + + + - - + - + |
- - - - - - - + - - |
- + - - + + + - + + |
- - - - - - - - - - |
- - - - - - - - - - |
5 15 15 6 2 2 13 2 1 5 |
66 |
|
| グラム陽性 桿 菌 |
I II III IV |
- + - - |
- + - + |
- + - - |
+ + - - |
F O |
- - - - |
4.0~4.2 5.4~5.6 5.4 5.6 |
- + + - |
- - - - |
- - - - |
- - - - |
- - - - |
- - - - |
- - - - |
7 3 1 2 |
13 |
|
| 酵 母 |
I II III |
- - - |
- + - |
- - - |
+ + + |
F O F |
- - - |
5.0 6.0 5.4~5.6 |
- - - |
- - - |
- - - |
- - + |
- - - |
- + - |
- - + |
1 1 5 |
7 |
|
| 微 生 物 |
性 状 群 |
牛 乳 培 地 の 生 育 |
ゼ ラ チ ン 消 化 |
酸 生 成 |
硫 酸 塩 還 元 |
イ ン ド | ル 産 生 |
硫 化 水 素 産 生 |
好 気 的 発 育 |
分 離 株 数 |
|||||||||||
| グ ル コ | ズ |
シ ュ | ク ロ | ズ |
マ ル ト | ズ |
ラ ク ト | ズ |
で ん 粉 |
グ リ セ リ ン |
サ リ シ ン |
マ ン ニ ッ ト |
マ ン ノ | ズ |
キ シ ロ | ズ |
ソ ル ボ | ズ |
ア ラ ビ イ ズ |
|||||||||
| グラム陽性 球 菌 |
I II III IV V |
- - C St D |
+ + - + - |
+ - - + + |
+ - - + + |
+ - - + + |
- - - + - |
- - - - - |
- - - - - |
- - - - + |
- - - - - |
+ - - + - |
+ - - - + |
- - - + - |
+ - - - - |
- - + + - |
- - - + - |
- - - - - |
+ - - + + |
8 3 1 1 1 |
| グラム陽性 桿 菌 |
I II III IV V VI |
- - D - - D |
- - + - - - |
- - + + + - |
- - + - + - |
- - - + - - |
- - - - - - |
- - - - - - |
- - + + - - |
- - - - + - |
- - - - - - |
- + + + + - |
- - - - - - |
- - - - - - |
- - - - - - |
- - + + - - |
- - - - - - |
+ - - - - - |
- - - - - - |
|
| 計 グラム陽性球菌 14株 グラム陰性桿菌 10株 計 24 株 |
||||||||||||||||||||
| * C:凝固 D:消化、 St:蜂巣状醗酵 |
| 微 生 物 |
線 量 |
分 離 株 数 |
||||||
| 0 krad |
100 krad |
200 krad |
300 krad |
|||||
| 株数 |
dominant |
株数 |
dominant |
株数 |
dominant |
dominant |
||
| グラム 陰性 桿菌 好 グラム 陽性 気 球菌 グラム 性 陽性 桿菌 酵 母 |
34 2 5 0 |
Pseudomonas (I,II,V)* |
1 24 5 1 |
Micrococcus (II,III) Lactobacillus (I) |
0 20 1 2 |
Micrococcus (II,III,VII) |
Micrococcus (II,VII) |
|
| 小 計 |
41 |
|
31 |
|
23 |
|
|
121 |
| グラム 嫌 陽性 球菌 気 グラム 性 陽性 桿菌 |
8 5 |
Staphylococcus (I) Bacteroides (V) |
4 4 |
Staphylococcus (I) Cerynebacterium (IV) |
2 1 |
Staphylococcus (II) |
|
|
| 小 計 |
13 |
|
8 |
|
3 |
|
|
24 |
| *それぞれの性状群 |
 |
3-1と同じスケソータラすり身試料に300kradのγ線照射を行ったのち、ただちにかまぼこ研究所において擂潰、手付成型、加熱して調製した板付かまぼこ(すり身照射かまぼこと略称)、ならびに比較のため同じすり身で照射しないまま製造したかまぼこ(無処理かまぼこと略称)、およびこの無処理かまぼこに300kradの照射を行った試料(製品照射かまぼこと略称)の3種類のかまぼこを試料とした。
上記3種類の試料かまぼこを5個づつ10℃および室温(25~30℃)に貯蔵し、10℃貯蔵では10、17、24、31日目に、室温貯蔵では3、5、7日目に微生物群測定のため、それぞれ3個のかまぼこから合計10gの試料片をとり、殺菌りん酸緩衝液30mlをくわえて乳鉢中で無菌的に充分すりつぶして乳濁状の測定原液とし、適当に稀釈して下記の5群に分けて微生物群の菌数測定を行い、試料かまぼこ1g当たり菌数に換算した。
(a)一般細菌群: Nutrient agar (肉エキス
5g、ペプトン10g,ぶどう糖1g,粉
末寒天15gを蒸留水1lに溶解、pH
7.0に調製後加圧滅菌)を溶解し、固化
寸前に測定試料を加えてペトリ皿に注入、
固化させ、37℃、2日間培養して生じた
コロニーをカウントする。
(b)低温細菌群: 一般細菌群と同一方法を用い、ただし15
℃、5日間の培養を行う。
(c)大腸菌群: Desoxycholate agar
(ペプトン10g,乳糖10g,食塩5g
,クエン酸鉄アンモニウム2g,リン酸2
カリウム2gを蒸留水1lに溶解し、pH
7.3~7.5に調製したのちデスオキシ
コール酸ナトリウム1g,ニュートラルレ
ッド0.033g,粉末寒天15gを加え
、100℃で10分間加熱殺菌)を調製し
、固化寸前に測定試料を加えてペトリ皿に
注入固化させ、37℃、3日間培養して生
じた暗紅色コロニーをカウントする。
(d)中性糸状菌群: Potato-dextrose aga
r (角切りした馬鈴薯200gを蒸留水
1l中で20分間煮沸し、ガーゼでろ過後
ぶどう糖20gを加えpH7.0に調製し
粉末寒天18gを加えて加圧滅菌)を溶解
し、ペトリ皿に注入、固化させたのち、測
定試料0.5mlを注入、グラスロッドで
塗布し、30℃、3日間培養、生じたコロ
ニーをカウントする。
(e)酸性糸状菌群: 中性糸状菌数と同一方法であるが、Pot
ato-dextrose agar 調
製にさいし、酒石酸溶液を用いて培地のp
Hを4.0とする。
10℃に貯蔵した場合の各試料かまぼこ1g当たりの各微生物群菌数の測定結果を表3-4に示す。大腸菌群は全ての場合検出されず陰性であった。
無処理かまぼこの一般および低温殺菌群菌数は11日目に10・E(5)個/g,18~24日目に10・E(8)/gのオーダーに達し、また酸性および中性糸状菌群菌数は18日目に10・E(8)個/g、24日目に10・E(4)個/g、31日目に10・E(6)個/gに達する。これに対してすり身照射かまぼこの生菌数もまたほとんど同様な数値を示した。一方、製品照射かまぼこでの細菌数は24日目に10・E(5)個/g、31日目に10・E(7)個/g、糸状菌数は24日目に10・E(3)個/g、31日目に10・E(5)個/gと、他の試料に比し明らかに少ない。
10℃貯蔵中における菌数増加を図示すると図3-2-(1)および 図3-2-(2)のようになる。
図で明らかなように、どの微生物群の増殖力でも、照射しない無処理かまぼこと照射したすり身から製造したすり身照射かまぼことは殆ど一致しており、かまぼこを製造したのち照射処理を行った製品照射かまぼこの場合のみ貯蔵初期の菌数増加が著しく抑制されていて照射効果の大きいことを示している。
なお室温貯蔵ではどの試料でも細菌数が急激に増加し腐敗したため糸状菌の生育は抑制されたが、やはりすり身照射の効果は全く認められない。
前記3-1の試験結果によれば原料すり身に照射した直後は相当な細菌数減少が見られるに拘らず、照射したすり身から製造したかまぼこで照射効果の見られない理由は、かまぼこ製造工程中における微生物に2次的混入や空板に由来する微生物が、元来の原料すり身から由来する微生物よりも大きな比重を占めるためと思われる。従って貯蔵期間延長を目的とするγ線照射に当たっては、かまぼこ原料であるすり身の照射は実用的に意味が少なく、かまぼこ製品に対する照射ははるかに殺菌効果が大きいものと判断される。
|
10℃で貯蔵中の各試料かまぼこ1g当たり微生物菌数 |
| |
貯 蔵 日 数 |
||||
| 11 |
18 |
24 |
31 |
||
| 無 処 理 か ま ぼ こ |
一 般 細菌群 低 温 細菌群 大 腸 菌 群 酸 性 糸状菌群 中 性 糸状菌群 |
3.9×10・E(5) 4.6×10・E(5) - 2.4×10 1.6×10 |
- 7.3×10・E(7) - 4.1×10・E(3) 4.0×10・E(3) |
6.0×10・E(8) 8.0×10・E(8) - 1.8×10・E(4) 1.4×10・E(4) |
5.0×10・E(8) 5.2×10・E(8) - 1.8×10・E(6) 2.0×10・E(6) |
| す り 身 照 射 か ま ぼ こ |
一 般 細菌群 低 温 細菌群 大 腸 菌 群 酸 性 糸状菌群 中 性 糸状菌群 |
7.1×10・E(5) 6.3×10・E(5) - 3.2×10 8.0×10 |
1.0×10・E(7) 2.4×10・E(8) - 2.2×10・E(4) 3.9×10・E(3) |
2.7×10・E(8) 3.8×10・E(8) - 3.0×10・E(4) 1.6×10・E(4) |
8.0×10・E(7) 1.0×10・E(8) - 4.0×10・E(5) 1.1×10・E(6) |
| 製 品 照 射 か ま ぼ こ |
一 般 細菌群 低 温 細菌群 大 腸 菌 群 酸 性 糸状菌群 中 性 糸状菌群 |
- - - - - |
9.2×10 - - 1.8×10・E(2) 2.7×10・E(2) |
1.3×10・E(5) 1.3×10・E(5) - 1.5×10・E(3) 2.6×10・E(3) |
2.4×10・E(7) 2.4×10・E(7) - 1.0×10・E(5) 1.1×10・E(5) |
|
37℃で貯蔵中の各試料かまぼこ1g当り微生物菌数 |
| |
貯 蔵 日 数 |
||||
| 0 |
3 |
5 |
7 |
||
| 無 処 理 か ま ぼ こ |
一 般 細菌群 低 温 細菌群 大 腸 菌 群 酸 性 糸状菌群 中 性 糸状菌群 |
- - - - - |
6.9×10・E(7) - - - - |
9.2×10・E(8) 4.5×10・E(5) - - - |
7.6×10・E(8) 6.3×10・E(7) - - - |
| す り 身 照 射 か ま ぼ こ |
一 般 細菌群 低 温 細菌群 大 腸 菌 群 酸 性 糸状菌群 中 性 糸状菌群 |
- - - - - |
7.4×10・E(7) - - - - |
4.0×10・E(8) 1.2×10・E(6) - 1.2×10・E(2) - |
6.0×10・E(8) 1.6×10・E(7) - 4.2×10・E(3) - |
| 製 品 照 射 か ま ぼ こ |
一 般 細菌群 低 温 細菌群 大 腸 菌 群 酸 性 糸状菌群 中 性 糸状菌群 |
- - - - - |
2.0×10・E(7) - - - - |
4.3×10・E(8) 5.9×10・E(5) - - - |
9.5×10・E(8) 1.1×10・E(6) - - - |
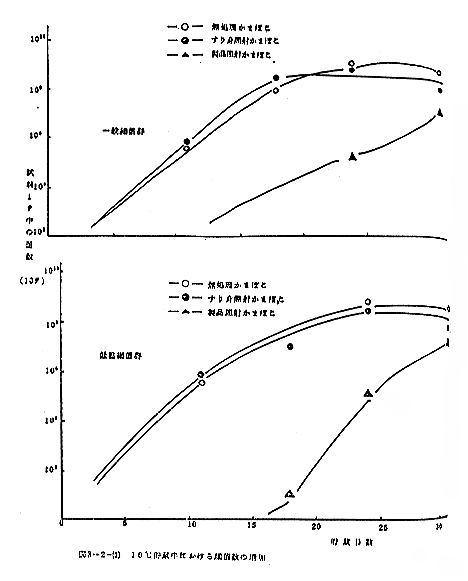 |
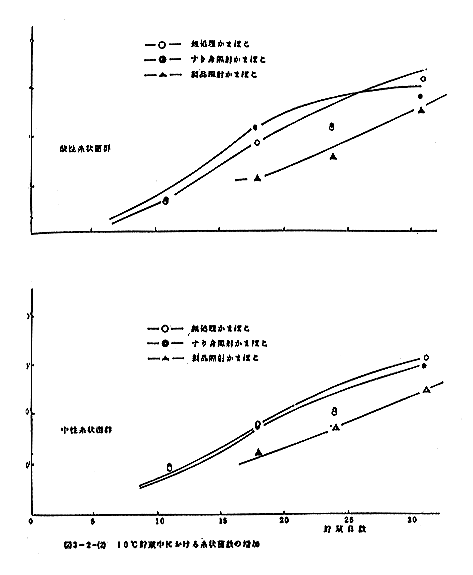 |
前記3-1の冷凍すり身を冷凍したまま空輸(東京-札幌間)したものを使用した。
冷凍すり身を冷蔵室(約5℃)で24時間解凍後、300kradのγ線照射(北海道大学設置のCo-60γ線照射装置、線量率5.40×10・E(4)rad/h、室温)を行った。
タラすり身から試食用団子(0.8%NaCl添加)を調製し、18人の訓練されていないパネルにより3点比較法と、同時に両者のいずれをよしとするかについての嗜好テストを行った。
揮発性成分の測定は次のように行った。非照射または照射(300krad)試料それぞれ200gを取り、水300mlを加えてミキサーで1分間磨砕し、600ml容試薬瓶に入れてシリコンゴム栓をした。注射器で脱気(30ml)を行った後、湯浴中(98℃)で30分間加熱し、head space vapor 10mlを取り、ガスクロマトグラフ(日立K-53形)で分析を行った。カラム充填剤としては、20%PEG400(担体:2N-NaOH処理Celite 545、60~80メッシュ)、20%PEG400(無処理Celite 545)、10%PEG 20M(酸洗Celite 545)、20% Reoplex(酸洗C-22)、5%SE-30-(クロモソルブW)等を用いた。
さらに揮発性成分の同定のために試料3×200gより同様に処理してhead space vapor を10mlずつ20~30回取り、カラム(2m×3mm i.d.)の中央部20cmほどをドライアイス・エタノール浴で冷却したGC-MS分析装置(GC:日立K-53形、MS:日立RMS-4形)に注入した。次にドライアイス・エタノール浴を取り除き、カラム温度を80℃まで昇温(3℃/min)して各ピークのマススペクトルを測定した。
官能検査の結果は次の通りである。3点比較法の判定総数18、正解識別数12から、照射した試料としない試料との差は1%危険率で識別できる。
また嗜好テストは識別正解数12のうち、照射したものをよしとする4、非照射をよしとする7、どちらでもよし1から、5%危険率で照射した試料より非照射の試料が好まれるという結果になった。識別テストについては、別に行った官能検査においても同様の結果が得られた。しかし、嗜好テストについては、官能検査のやり方によっては異なる結果が得られることが予想される。
揮発性成分のガスクロマトグラフィによる測定の結果は次の通りである。各種カラムを用い、またはカラム温度等の条件を変えて測定を行ったが、最も良い分離が得られた例を図3-3に示す。これは、カラム:20%PEG 400(担体:2N NaOH処理Celite 545、60~80メッシュ)。2m×3mm i.d.,カラム温度:37~38℃、N2(キャリヤーガス):0.6kg/cm3、H2:1.0kg/cm3、空気:1.0kg/cm3、注入口温度:130℃の諸条件で行ったものである。
さらにGC-MSで各ピークのマススペクトルを測定し、標品との比較を行った結果、次の各成分が同定された。ピーク 2:trimethylamine、3:acetaldehyde,4:acetone、6:ethyl acetate、9:ethanol である。なお、ピーク1はmixture、10はM+74である。また、ピーク7はM+が200以上(重合したためか?)、8は放置すると減少するためか情報が得られなかった。
照射(300krad)した試料では、非照射の試料に現れるピーク7(unknown)、8(unknown)および10(unknown、M+74)が顕著に減少あるいは検出されなくなるのに対して、ピーク1(mixture)、2(trimethylamine)および3(acetaldehyde)のより揮発性成分が顕著に増加していることが特徴である。
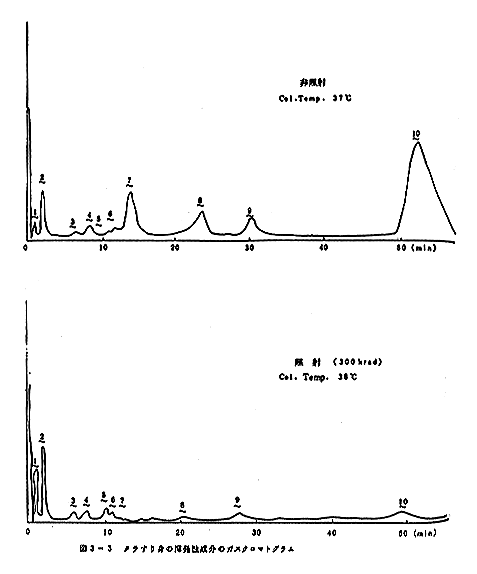 |
特級スケソータラ無塩冷凍すり身(3-1項と同一試料)を、5℃24h解凍した後に、Co-60γ線300krad照射(線量率 360krad/h)した。照射および未照射の試料をトリクロロ酢酸溶液で5倍容に稀釈(終濃度10%)攪拌後、上澄をとり、エーテルでトリクロロ酢酸を抽出除去してアミノ酸アナライザーで分析する。
遊離アミノ酸の分析値は表3-6の通りである。この表のとおりに、300krad照射では変化はほとんどない。メチオニンやヒスチジンのように放射線化学的、光化学的に不安定とされているアミノ酸にもほとんど変化は認められない。例外として、グルタミン酸のみが、0.49μmoles/gから1.13μmoles/gに増加している。絶対量は小さい変化であるが、同じ傾向はジャガイモの照射でも認められている。すり身というものの性質から考えて、放射線が生化学的な反応を誘起した結果とは考えられず、これは放射線化学的な変化と解釈するのが妥当であろう。
|
(単位 μmoles/g) |
| |
未照射 |
300krad 照射 |
| Lys His Arg Asp Thr Ser Glu Pro Gly Ala Cys Val Met Ile Leu Tyr Phe |
5.90 2.96 1.53 1.23 1.30 1.02 0.49 1.04 3.46 4.15 0 0.80 1.01 0.42 0.75 0.31 0.33 |
5.60 2.43 1.35 1.13 1.34 1.34 1.13 0.83 3.42 4.46 0 0.88 0.98 0.46 0.73 0.35 0.37 |
3-1項と同一の試料を使用した。
(a)全 窒 素: ミクロ・ケルダール法で定量した。
(b)蛋白質の定量:Goronallのビュレット法で540m
μの波長を用いて定量した。標準蛋白質とし
てはBovine serum album
in(NBC社製)を用いた。
(c)水分の定量: 常法に従って定量した。(110℃恒量に達
するまで、約14時間)
(d)蛋白質の抽出溶媒:
奥田、Straubらによって魚類、筋肉蛋
白質を抽出する際に用いられた溶媒などを用
いた。
a) 水
b) 70%アルコール
c) 0.2%KOH
d) 10% NaCl
e) 塩化カリ-りん酸混液(0.3MK
Cl 0.15Mりん酸カリを含む
溶液をNaOHでpH 6.5に調
製したもの
f) e)の溶液にKCNSを5%になる
ように溶解させた溶液
g) e)の溶液にKCNSを10%にな
るように溶解させた溶液
(e)すり身からの各種溶媒による蛋白質の抽出方法:冷蔵庫(2
℃~5℃)で24時間解凍させたすり身(w
et weight 1g)に対して各種溶
媒 100mlを加え、ホモジナイザーによ
り氷冷下で5分間均質化し、5℃で10,0
00rpm,10分間遠心した上澄液を蛋白
質の試料とした。
(f)ディスク電気泳動法:照射および非照射のすり身から抽出し
た蛋白質の電気泳動的性質の分布を検討する
ために永井の方法に準じてディスクの電気泳
動を行った。すなわち、分離用ゲル7.5%
、濃縮用ゲル2.5%とし、pH8.3(ト
リスーグリシン)緩衝液で1tubeあたり
3mAの定電流で50分間泳動させた後、ア
ミノブラック10Bで染色した。試料の調製
は溶液0.15mlあたり 600μgにな
るように溶解させ、濃縮ゲルの上に静かに注
入した。
(g)照射方法: 理化学研究所のCo-60γ線照射装置を用
いた。すり身(3×4×6cm程度)を24
時間にわたり冷蔵庫(2℃~5℃)で解凍さ
せ、その半分を300krad照射し、他の
半分を対照とした。照射は半径4.5cm、
厚さ2cmのシャーレに入れて、23分ずつ
表裏均等な線量となるよう反転しつつ計46
分間照射した。
(h)超遠心分析: 照射および非照射すり身から0.2%KOH
溶液で抽出した蛋白質溶液を0.2%KOH
に対して十分に透析(24時間、5℃)した
ものを超遠心分析用の試料とした。超遠心分
析の最高回転数は55,430rpmで10
分おきに撮影した。
(1)すり身からの各種溶媒による蛋白質抽出条件の検討:
すり身から蛋白質をできるだけ高収量で抽出するため
に、ii.(d)項の各種溶媒で蛋白質の抽出を検討し
た結果が表3-7である。この表からあきらかなように
、0.2%KOHの溶媒による抽出率が98%と最も高
く、70%アルコール、10%NaCl、5%、10%
のKCNSを含む塩化カリ-りん酸混液らの溶媒による
蛋白質の抽出率は30~60%であった。一方、水、塩
化カリ-りん酸混液の溶媒はいずれも抽出率が15~2
0%で最も低い。また、0.2%KOHの溶媒による照
射後のすり身蛋白質の抽出率は96%であった。このこ
とは照射前後のすり身蛋白質の抽出率にはほとんど差が
なく、蛋白質としての溶解性からは変化はみとめられな
かった。
(2)ディスク電気泳動図:
照射と非照射のすり身から0.2%KOH(pH12
.4)の溶媒を用いて抽出した蛋白質をディスク電気泳
動的に比較検討した結果が図3-4である。泳動時の試
料は塩酸でpH8.8に調製し、サッカロースを加えて
電気泳動を行った。図に示されるように照射、非照射の
すり身から抽出した蛋白質はいずれもpH8.3で7本
のバンドにわかれ、同じ易動度を示した。このことは3
00krad照射してもすり身蛋白質は電気的にはほと
んど変化がないものとみなされる。
(3)超遠心図:
照射と非照射のすり身から0.2%KOHで抽出した
蛋白質溶液の沈降図を比較検討した。0.2%KOHで
抽出した蛋白質溶液を55,430rpmで50分後を
求めた。その結果、非照射蛋白質は単一なピークを示し
、沈降係数2.49Sであった。一方、照射すり身から
抽出した蛋白質の沈降係数は主要部分は2.49Sであ
ったが、5.5Sの小部分が観察された。このことから
すり身蛋白質は照射によって一部分重合するようである
が、ほとんど変化しないものと考えられる。
(4)以上総合すると、照射前後のすり身蛋白質としての性状に
は大きな変化は起こっていないものとみなされる。
| 溶 媒 |
抽出率(%)* |
| 水 70% アルコール 0.2% KOH(pH12.4) 10% NaCl 塩化カリ-燐酸混液(pH6.5) 5%KCNS(塩化カリ-燐酸混液中) 10%KCNS( 〃 ) |
15 46 98(96)** 61 21 41 33 |
| * ピュレット法 ** 照射後の抽出率 |
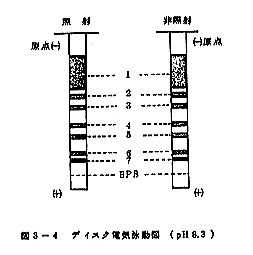 |
北海道産冷凍タラすり身および北海道近海産タラ肉を用いた。
解凍したすり身は小型バイアルびんに10gづつ、またタラ肉はポリエチレン袋に30gづつ秤取し、ボツリヌスE型菌芽胞を魚肉当たり10・E(4)/gおよび10・E(6)(すり身)ならびに10・E(2)/gおよび10・E(4)/g(タラ肉)になるよう接種した。試料は5%で300kradの照射を行い、以後5℃で貯蔵し、毒性試験に供した。
毒性試験は次のように行った。
すり身: バイアルびん(3本につき1試料とした)は、一定期間
毎に取り出しバイアルびん1本につき2倍量の0.2M
リン酸塩緩衝液(pH6.0)を加えて毒素を抽出した
後、高速遠沈上澄(10,000rpm、10分)につ
いてトリプシン活性化処理および非処理試料を作成し、
体重約20gのマウス腹腔内に0.5mlずつ注射して
48時間までの生死を判定した。ボツリヌスE型毒素の
判定は、特異的中毒症状観察のほか抗血清による中和試
験を併用した。
タラ肉: 1袋(30g)の切身に冷0.2Mりん酸緩衝液(pH
6.0)45mmlを加えて氷冷下でホモジナイズする
。そのまま一夜氷室に保存して毒素を抽出する。翌朝遠
心分離(10,000rpm,10分)して上澄を得、
この上澄2mlに2.5%トリプシン(1:250)
0.5Mりん酸緩衝液(pH6.0)0.5mlを加え
て37℃に1時間保ち、ついで直ちに氷冷して反応を止
める。この反応液1mlに0.1%ゼラチン加0.1M
りん酸緩衝液(pH6.0)1mlを加えて室温に1時
間放置し、中和試験液とした。これら試験液は同時にマ
ウス2匹ずつにそれぞれ0.5mlずつ腹腔内注射し、
72時間までの生死を判定した。
すり身についての結果は表3-7に、タラ肉についての結果は表3-8に示す。照射試料、非照射試料とも、33日(すり身)6週間(タラ肉)にいたるまで、全く毒素の生成を見なかった。
非照射試料では一般細菌数の増加が著しく、これがボツリヌスE型菌の生育を阻害しているとも考えられるが、照射試料では、一般細菌数は相対的に少数である。従って、少なくとも照射試料において、ボツリヌスE型菌の生育、毒素生産性が促進されることはないと推論される。
| 溶 媒 |
抽出率(%)* |
| 水 70% アルコール 0.2% KOH(pH12.4) 10% NaCl 塩化カリ-燐酸混液(pH6.5) 5%KCNS(塩化カリ-燐酸混液中) 10%KCNS( 〃 ) |
15 46 98(96)** 61 21 41 33 |
| * ピュレット法 ** 照射後の抽出率 |
|
照射および非照射すり身の保存中における毒性試験 |
| 保存日数 (日) |
非 照 射 試 料 |
照 射 試 料 |
||||||
| 10・E(4)/g |
接 種 |
10・E(6)/g |
接 種 |
10・E(4)/g |
接 種 |
10・E(6)/g |
接 種 |
|
| U D |
T D |
U D |
T D |
U D |
T D |
U D |
T D |
|
| 10 19 25 33 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 |
|
照射および非照射タラ切身の5℃保存中における毒性試験(包装材:非通気性ポリエチレン) |
| 保存期間 (週) |
非 照 射 試 料 |
照 射 試 料 |
||
| 10・E(2)/g |
10・E(4)/g |
10・E(2)/g |
10・E(4)/g |
|
| 2 3 4 5 6 |
0/3 0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 0/3 |
0/3 0/3 0/3 0/3 0/3 |
以上の試験研究の結果から下記のように結論される。
1.蒸し板かまぼこに300kradのガンマ線照射を行うとわずかながら弾性が増加して色が白くなり(ハンター白度が増大)、品質が向上する。室温で5日間貯蔵すると、非照射試料では品質が著しく劣化するのに対し、照射試料では殆ど品質が低下しない。5℃で貯蔵した場合、照射試料では2週間後から弾性、ことにヂェリ-強度が増大し、品質が向上する。更に1ヶ月後には照射試料はそのまま品質を保つが、非照射試料では品質の劣化が著しくなる。弾性(足)の官能検査の結果も明らかに照射試料の品質が優れていることを示した。
照射により付着微生物は1/10~1/1,000に減少するが、照射後室温貯蔵したのでは生菌数は増加し貯蔵性をあまり延長することは出来ない。5℃で冷蔵する場合は照射後の生菌数増加は長期間(4週間)にわたって抑制される。従って、300kradの照射と冷蔵との併用によってかまぼこの貯蔵性は改善されることが明らかとなった。
2.上記の場合、かまぼこ中の総菌数、好気性細菌数および嫌気性細菌数はいずれも照射により著しく減少し、貯蔵中における菌数増加は照射試料では常に少ない。照射試料について、各種細菌、糸状菌、酵母を多数分離し、それらの形状を検討したが、放射線高抵抗菌数をはじめ特殊な微生物は検出しなかった。
3.上記かまぼこ中の揮発性成分、アミノ酸類、糖類、各種添加物、調味料に対する照射の影響を検討したが非照射試料との間に著しい相違は認められない。保存料は照射により分解を受けるが、ソルビン酸の添加は殺菌効果を向上させた。
4.蒸し板かまぼこ調製に際しての空板の照射、加熱時間の長短ならびに包装材料の相違は、幾分か照射後の貯蔵性に関与するが、照射、非照射の試料間では大差がない。
5.蒸し板かまぼこと同一組成の原料をサランフィルムに充填したケーシング詰かまぼこについて、300kradのガンマ線照射を行ったところ、照射試料の弾性および白度は明らかに増大し、味はいくぶん淡白になる傾向はあるが、香りの変化はなく全体として品質の向上が見られた。10℃に貯蔵した場合、非照射試料の可食期間が28日であるのに対し、照射試料の可食期間は180日以上であって著しい貯蔵期間延長効果を示した。照射試料では貯蔵中の品質低下が著しくおそく、官能検査の結果は常に非照射試料よりも良好であった。30℃で貯蔵すると非照射試料は1日で、照射試料は3日で軟化腐敗し、やや照射効果がみられる程度であった。総菌数、好気性細菌数、嫌気性細菌数は照射により著しく減少し、貯蔵中における菌数増加は照射試料では常に少ない。
6.上記ケーシング詰かまぼこ中の蛋白質の物理化学的性状、遊離アミノ酸、揮発性成分、糖類、核酸系調味料は照射によりほとんど影響を受けなかった。
7.かまぼこの主原料であるスケソータラすり身は300krad照射により好気性菌、嫌気性菌とともに生菌数が減少し、かまぼこ調製後照射した場合と同様に明瞭な殺菌効果が認められたが、照射すり身で調製したかまぼこの貯蔵中のミクロフローラおよび生菌数の変化にはすり身照射の効果が認められなかった。蛋白質の性状、遊離アミノ酸には照射の影響がなく、揮発性成分には幾分かの相違が見られた。
8.原料すり身およびタラ肉にボツリヌスE型菌芽胞を接種し毒素生産性を調べたが、照射によりE型菌の生育が促進されることはなかった。
|
|