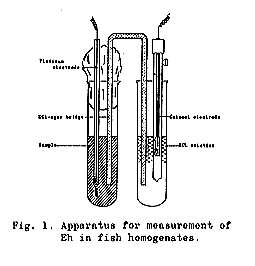
Fig.1. Apparatus for measurement of Eh in fish homogenates.
 |
一般に魚の放射線照射による保蔵においては、低線量レベル(0.1〜0.5Mrad)の放射線パスツリゼーションが有利とされている。しかしながら、そのようや低線量照射では、一般腐敗細菌のほとんどは死滅するであろうが、ボツリヌスE型菌芽胞はそのD値〔3,7,9〕からみて、かなりの数が生き残り、その結果発育に好適条件が与えられるならば、いつでも毒素を産生する可能性があるであろう。
Schmidtら〔8〕は放射線照射におけるパスツリゼーション線量は、ボツリヌスE型菌芽胞を完全に殺滅し得ないであろうと述べている。またCannら〔4,5〕は魚におけるボツリヌスE型菌の接種試験において、照射に生き残ったE型菌芽胞が、これに相当する数の照射されない魚における芽胞よりもっと速く発育して毒素を産生することを認め、放射線パスツリゼーションした魚がボツリヌスE型菌によって速かに毒性化される可能性を暗示した。
このように魚の放射線パスツリゼーションに関しては、ボツリヌスE型菌に対する安全性の点でなお疑問の余地が残されている。そこで今回のわれわれの実験においては、E型菌芽胞を接種した魚肉ホモジェネートを用い、これを低線量照射した後室温附近(20℃,10℃)に保存した場合、毒素産生がどのようにして起るかを、腐敗との関連性あるいは酸化還元電位の変化などから追究することとした。
新鮮なニシンの肉質部にこれと同量の滅菌蒸溜水を加えてミキサーにかけ、ホモジェネートを作製した。これを試験管(18×150mm)に各10gずつ分注し、さらにClostridium botulinum type E Iwanai発胞を、10・E(5)/gの割に接種した。接種された試験管は照射するまで氷冷下に保存した。
接種された試験は、翌朝コバルト60(約1,800Ci)照射装置で0.1および0.3Mradの照射量で照射された。照射中の温度は10〜4℃を保った。照射直後両線量区分とも非照射コントロールとともにそれぞれ10℃または20℃の恒温器に入れて保存した。
一定期間保存した試験管をとり出し、その内容物を別の滅菌容器に20mlの0.1%ペプトン生理食塩水溶液で完全に洗い出す。これをよく混合して以下の試験に供した。
上記試料を2,000rpm,15分間遠心分離してその上清をとり、これに同量の0.2%トリプシン(1:250)リン酸バッハー(pH6.0)溶液を加えて37℃に1時間インキュベートする。活性化された毒素液をゼラチンリン酸バッハー(pH6.0)で希釈し、その0.5mlを各2匹ずつのマウス腹腔内に注射した。典型的ボツリヌス中毒症状を呈して死亡するまで2日間観察した。
Corlettら〔6〕のTPN寒天を用いて二重平板法を行なった。25℃で48時間培養して全コロニー数をカウントした。
Conwayに微量拡散分析法によった。
照射および非照射資料のEhを測定する装置をFig.1に示す。白金電極はクロム硫酸につけてよく清浄にし、蒸留水で完全に洗った後、使用直前にメタノール炎で乾燥した。電極をホモジェネートする場合、できるだけ深く沈めた。Ehの測定は「日立−堀場」M−5型pHメーターに自動記録装置をつけて行なった。測定中試料−電極系をなるべく乱さないように注意した。
 |
菌数の変化をFig.2に示す。0.1および0.3Mradの照射は、最初の菌数をそれぞれ82.0%および97.2%に減少させた。20℃保存の場合、非照射試料の菌数は急速に増加して2日後に最高値に達したが、照射試料のそれはもっとゆっくりで5日後に最高値に達した。一方10℃保存の場合、20℃保存とほゞ同様の傾向がみられたが、照射および非照射試料のおのおのがその最高値に達するのに、20℃の場合の約4倍の日数を要した。
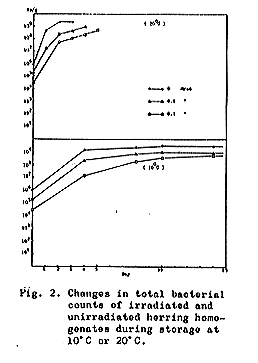 |
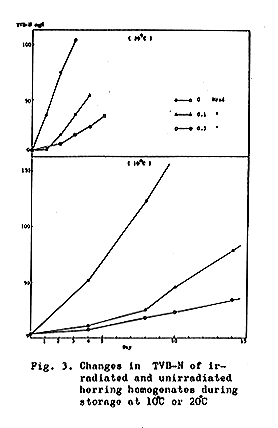
Fig.3に示すように、非照射試料では両保存温度ともほとんど直線的増加がみられた。一方照射試料ではいく分ラグがみられ、その後ゆっくり増加を示した。
TVBが30mg%を超えると、明らかに腐敗臭が全試料について認められた。照射および非照試料のTVBが30mg%を超える際の保存日数は、非照射試料では、10℃で2〜4日、20℃で1日であり、0.1Mrad照射試料では、10℃で8〜10日、20℃で3日であり、また0.3Mrad照射試料では、10℃で12〜14日、20℃で5日であった。
 |
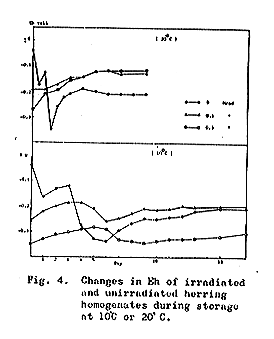
保存期間中のEhの変化を、電位時間曲線として追跡するとFig.4に示すとおりである。
非照射試料を10℃に保存した場合、電位は初め−0.03ボルトから徐々に低下し、6日後に最低値に−0.33ボルトになり、それからゆっくり上昇して15日後には−0.20ボルトを示していた。同試料を20℃に保存した場合は、電位は急速に低下し、36時間で最低値−0.35ボルトに達し、次いで終局電位の−0.20ボルトにまで上昇した。
一方照射試料では、顕著なことに、すべての初期電位は非照射試料のそれよりさらにマイナス側に緩衝されていた。10℃保存の場合、初期電位は0.1および0.3Mradでそれぞれ−0.25および−0.34ボルトであった。これらの電位は保存期間中いくらか波のある変動を経て、0.1および0.3Mradでそれぞれ−0.20および−0.31ボルトの終局電位を示した。また20℃保存の場合、初期電位は0.1および0.3Mradでそれぞれ−0.19および−0.27ボルトを示し、終局電位は同じく0.11ボルトを示した。
 |
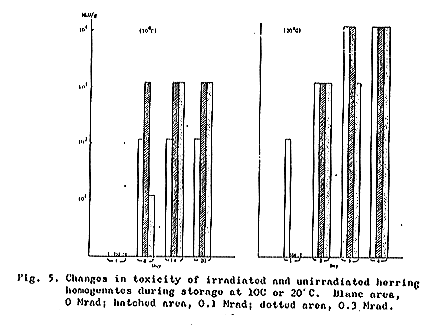
照射および非照射試料の10℃および20℃保存中における毒素産生の変化を示すと、Fig.5のとおりである。
10℃保存の場合、すべての試料について4日後に検出し得る量の毒素は見出されなかった。しかし8日後では多かれ少なかれ毒素が検出された。0.1Mrad照射試料に最高レベルの毒素が見出されたが、0.3Mradのものは最低であった。14−20日間の保存では、非照射試料よりもっと多くの毒素が両照射量の試料中に見出された。
20℃保存の場合、非照射試料ではわずか1日後に毒性が認められるようになり、3日後には最高の強さに達した。一方照射試料では2日後に毒性を示すようになり、0.1Mradでは3日後、0.3Mradでは4日後にそれぞれ最高値を示した。
毒素産生は10℃より20℃保存の方が、その生成速度および強さの点で優れていることがわかる。
 |
全菌数の変化をTVBおよびEhの変化と比較すると、照射試料におけるこれらの変化値間の関係は、非照射試料におけるそれとやや異なっている。すなわち非照射試料では、菌数はTVBの直線的増加およびEhの初期の低下と平行しているが、照射試料では、これらの値の変化は必ずしも平行していない。照射試料のTVBの生成速度は比較的遅く、従って菌数が10・E(7)のオーダーを超えるまでTVBの直線的増加はみられなかった。しかも電位時間曲線にこれらの変化は反映されていない。その原因は、揮発性塩基の発生に由来する微生物が照射によっていちじるしく減少したためと考えられる。
先に著者ら〔2〕は高圧滅菌した魚肉ホモジェネートが、その低い初期電位のためボツリヌスE型菌の発育にとって格好の培地になる得ること、そしてまた滅菌しない魚肉でも保存中に起る腐敗あるいは自己消化にともなうEhの急激な低下のため、同菌の発育と毒素産生をもたらすことを報告した。
今回の実験において、酸化還元電位の測定に関して、とくに次の2点に関心が寄せられる。すなわち、
1)放射線パスツリゼーション線量が、魚肉に対して好気性か嫌気性かいずれの条件をもたらすか。
2)照射された魚肉の酸化還元電位の測定が、ボツリヌスE型菌の発育を判断する一つの指標になり得るか。
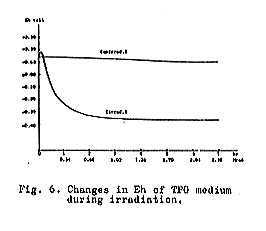
われわれの予備的実験によると、放射線照射はある好気的培養基および魚肉ホモジェネートの中のEhを急激に低下され得ることがわかった。たとえばTPG培地を0.3Mrad照射すると、Fig.6に示すように、Ehは+0.11ボルトより急激に低下して−0.25ボルトを示した。しかも照射によってつくられるこのような還元的条件は、ボツリヌスE型菌の発育を支持することがわかった。すなわちチオグリコレートを加えないTPG培地にE型菌芽胞を接種した後、0.3Mradに照射し、次いで20℃で培養すると48時間以内に明らかに発育がみられたが、これに反して照射しない対照では発育がみられなかった。
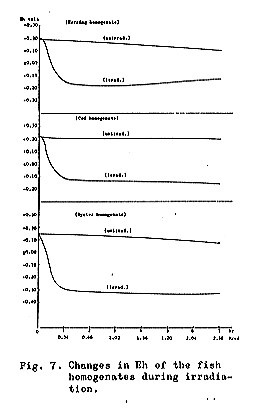
照射中における2,3の魚肉ホモジェネートのEhの変化をしらべた結果は、Fig.7に示されている。われわれの今回の実験から明らかなように、0.1または0.3Mradで照射されたニシンのホモジェネートは、かなり低いマイナスの初期電位を示しており、そのため照射に生き残ったボツリヌスE型菌芽胞の発育と毒素産生を支持したものといえよう。
一方非照射試料においても同様にEhの低下がみられ、その結果E型菌の発育と毒素産生が認められた。この場合は上述の場合と異なり、主として魚に附着している好気性ミクロフローラの繁殖にともなう酸素消費作用によるものと考えられる。
照射された魚肉におけるボツリヌスE型菌の発育と毒素産出に及ぼす因子として、接種菌数、照射量、保存温度および期間などが大いに関係するものと思われる。Abrahamssonら〔1〕はニシンフィレーにボツリヌスE型菌芽胞を2×10・E(6)/60gの割に接種した後、0.3Mradに照射して保存すると、20℃で64時間以内に毒素が認められ、そして真空包装したものの方がしないものよりはるかに毒素濃度が高かったと報告している。Cannら〔4,5〕は真空包装した魚肉を照射した後保存して毒素産生をしらべた結果、E型菌芽胞を10・E(5)/100gの割に接種して照射された試料の方が、残存数に相当する芽胞を接種して照射されなかった試料よりも多くの毒素が検出され、しかもその生成速度も約2倍であったと述べている。これと同様の結果は、今回のわれわれの実験結果においても認められ、照射試料の方が放射線殺菌によって芽胞数が減少しているにもかかわらず、非照射試料中より高い濃度の毒素が検出された。これらの観察を基にすれば、放射線パスツリゼーションは、ニシン肉におけるボツリヌスE型菌の毒素産生を、ある条件では助長するかのようにみえる。その原因としては、上述のように照射中におこる酸化還元電位の低下がE型菌の発育に有利な条件を与えるためと考えられる。
本研究はIAEA委託研究費(No3151RB)の補助により行なわれたものである。
 |
 |
ニシンのホモジェネートにボツリヌスE型菌芽胞を10・E(5)/gの割に接種して0,0.1,0.3Mradに照射した後、20℃または10℃に保存した。保存中一般細菌数、揮発性塩基、毒性、および酸化還元電位等が測定され、これらの指示値間の変化を照射試料と非照射試料との間で比較した。
非照射試料における毒素産生は非常に速いので、毒素産生に要する時間と腐敗時間との間に差がみられない。一方照射試料における毒素産生は、腐敗の認められる前に起り始めることがわかった。しかも照射試料の方が非照射試料より多くの毒素が検出された。
放射線パスツリゼーションが、ニシン魚肉におけるボツリヌスE型菌の発育と毒素産生を助長するかのような事実を、魚肉における酸化還元電位の立場より論じた。
〔1〕Abrahamsson,K.,De Silva,N.N.,
and Molin,N.
:Canad.J.Microbiol.,11,
523−529(1965)
〔2〕安藤芳明、井上勝弘:日本水産学会誌、23,458−462
(1957)
〔3〕安藤芳明、鹿島田隆、小野悌二、飯田広夫:本誌、第3巻、第1号,
5〜12(1969)
〔4〕Cann,D.C.,Wilson,B.B.,Hobbs,G.,
and Shewan,J.M.:J.Appl.Bact.,
28,431−436(1965)
〔5〕Cann,D.C.,Wilson,B.B.,
Shwean,J.M.,Roberts,T.A.,
and Rhodes,D.N.:J.Appl.Bact.,
29,540−548(1966)
〔6〕Corlett,Jr.D.A.,Lee,J.S.,
and Sinnhubor,R.O
:Appl.Microbiol.,13,808−817
(1965)
〔7〕Roberts,T.A.and Ingram,M.
:J.Appl.Bact.,28,125−141(1965)
〔8〕Schmidt,C.F.,Lechowich,R.V.,
and Folinazzo,J.F.:J.Food Sci.,
26−626−630(1961)
〔9〕Schmidt,C.F.,Nank,W.K.,
and Lechowich,R.V.:J.Food Sci.,
27,77−84(1962)
|
|