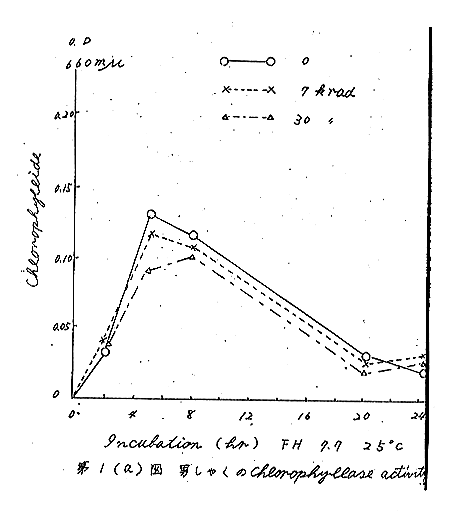
第1(a)図 男しゃくのChlorophyllase activity
 |
放射線、とくにX線照射によって、馬鈴薯の発芽を抑制し、貯蔵期間の延長をはかる試みは、すでに各国において実用化の段階に入っている。発芽抑制の目的に適った実用線量(7〜15krad)では、栄養価その他風味などに影響がみられず、また食品工業原料としての品質などにも、何等悪影響が認められていない。さらに、重要な問題としての長期動物飼育による安全性の確認試験においても、有害作用があるという報告は見当たらない。
しかし、一方、各国においても、いまだに照射食品であることを識別する方法は見出されていない。また、現状では、既に安全性が確認されている線量、すなわち、適正線量で照射が施されているか否かを識別する方法としては、照射時にラドカラーを貼付する方法以外には、
馬鈴薯は、生鮮農作物であり、その品種、作付環境、収穫時期、貯蔵期間あるいは条件が不明の場合は、試料採取の方法や対照物の採り方による変動の方が、はるかに大きい場合も考えられるので、物質レベルを問題とするならば、ある成分の消長あるいは、ある成分の新しい生成がみられた時に、はじめて照射の有無を確認することができるのではないかと考えられる。
以下、われわれが行ってきた照射処理の検知法に関する基礎的研究とその結果について報告する。
収穫時期:昭和44年6月26〜28日
産 地:長崎県
照射時期:昭和44年7月8日
貯蔵条件:温度;20〜22℃
湿度;50〜80%
期間;昭和44年7月10日〜昭和44年12月12日
収穫時期:昭和44年9月15〜20日
産 地:北海道
照射時期:昭和44年10月28日
貯蔵条件:温度;20〜22℃
湿度;50〜80%
期間;昭和44年11月4日〜昭和45年3月21日
収穫時期:昭和43年9月25日
産 地:北海道
照射時期:昭和43年11月13〜14日
貯蔵条件:温度;(室温)
湿度;成りゆき
期間;昭和43年11月25日〜昭和45年5月10日
収穫時期:昭和43年9月25日
産 地:北海道
照射時期:昭和43年11月13〜14日
貯蔵条件:温度;室温
湿度;成りゆき
期間;昭和43年11月25日〜昭和45年5月10日
日本原子力研究所
高崎研究所 γ線(Co−60)
何れも7、15および30kradの照射
塊茎の頂部および底部で栄養成分の分布が異なることから縦の輪切り(中心軸にそって)を3個体から平均に採取した。ただし、Peroxidaseについては横の輪切り(中心軸に直角に)とした。
Wohlgemuth法*1)に従い、pH5.0のAcetate buffer中で酵素液1mlが37℃30分で分解しうる1%可溶性澱粉液量を求めた(D37゜30’で表示)。また、mesteckey*10)によるstarch agar plateを用いて、簡便法についても検討した。
Bessey−Lowry法*2)により、酸性およびアルカリ性下で、p−nitrophenyl phosphateを基質としたときに生成するp−nitrophenolを410mμで比色定量した。
Reitman−Frankel法*3)に基づいて、alanineまたは、aparatic acid と 2−ketoglutaric acid を基質として、生成するPyruvic acidまたは、oxaloacetic acid をdinitrophenyl hydrazineにより発色、比色定量した。
Holden*4)の方法に従い、試料を50%以上のアセトン濃度で、脱水粉末となし、これをアセトン50%、クエン酸緩衝液(0.4M)、Cu−chlorophyll(2mg/ml)の基質中(pH8.0)に懸濁し、25℃で2、5、8、20時間のインキュベート後、分解生成物のchlorophyllideを分別し、比色定量した。
Tyrosinase*13)(CresolaseとCate cholase)、Peroxidase*13)などについても検討した。
水溶性総糖量は、除タンパク後、anthrone法で測定した。
Somogyi−Nelsonの変法*5)により定量し、グルコースとして表示した。
(i)から(ii)を差引き、蔗糖として表示した。
W.Woravdekar*6)らの方法に従い、過ヨウ素酸酸化により生成した malon=dialdehyde と thisbarbituric acidとの縮合物を比色定量した。
Roeの2.4−dinitrophenyl hydrazine 法にTLCを併用、改良した方法*7、8)を用いて定量した。なお、従来のRoeの原法では酸化型アスコルビン酸として定量したものが、TLCでは真のアスコルビン酸としては痕跡程度しか存在しないことが明かとなったので、総アスコルビン酸として定量、表示した。
アミノ酸のtyrosineはCeriotti*9)らの方法、クロロフィル、リグニン様物質(フロログルシン硫酸法)、ジベレリン酸*11)、無機リン*12)、アンモニア態窒素、アルデヒド類は常法により検討した。
試料3、4の貯蔵後3カ月目の発芽期の結果は、第1表の通りである。非照射、7krad照射のものは、15krad,30krad照射したものよりも、やや活性が高いが、貯蔵初期には、試料1、2を用いた場合でも、何れも活性が低く、差異は認められなかった。また、ジベレリン溶液(0.05M)に24時間浸漬しても、試料中の酵素賦活化は認められず、Amylaseの活性を比較することは、有効な手段とは考えられない。
| 品 種 |
線 量 |
D 37゜ 30’ |
| 男 し ゃ く 4 |
0(非照射) |
0.1 |
| 7 krad |
0.1 |
|
| 15 〃 |
0.1 |
|
| 30 〃 |
0.07 |
|
| 農 林 1 号 3 |
0(非照射) |
0.07 |
| 7 krad |
0.07 |
|
| 15 〃 |
0.05 |
|
| 30 〃 |
0.05 |
Acid phosphatase の測定結果は、第2表に示した。また、個体間の酵素活性値の「ばらつき」をみるため、男しゃくを選び、5個体の数値を求めたところ、各個体の活性値にみられる標準誤差は約7%であり、5%の危険率をみるとき信頼値は平均±17.6%の幅となった。従って第2表の結果から、照射の影響を、これによって推測することは困難であると思われる。
|
【Bessey−Lowry unit M/hr/g(fresh tissue)】 |
| 品種 |
線 量 (krad) |
照射後の貯蔵期間 |
||
| 0 ヶ月 |
1 ヶ月 |
2 ヶ月 |
||
| 島 原 1 |
0 7 15 30 |
0.79 0.57 0.68 0.90 |
0.68 0.79 0.79 0.60 |
0.68 0.57 0.68 0.68 |
| 農林1号 3 |
0 7 15 30 |
− − − − |
− − − − |
0.33 0.31 0.31 0.29 |
| 男しゃく 4 |
0 7 15 30 |
− − − − |
− − − − |
0.24 0.20 0.23 0.29 |
島原を選び、transaminaseの代表的な酵素活性としてGOT.GPTを測定し、第3表にその結果を示した。照射直後は、照射処理を施したものの方が高い値を示した。しかし、本測定のように、各群から出来るだけ大きさの揃った個体を5個選んで測定しても、各個体間のばらつきは、大体±7%(平均値)であった。したがって、5%の危険率をみるとき、信頼値の幅は±17%となり、未知の試料の酵素活性が高くとも、これが照射処理を施したものであるか否かを推定することはできない。また、農林1号および男しゃくについても上述同様な傾向を示した。
|
(単位:Karmens units、M/ml/g) |
| 線 量 (krad) |
G O T |
G P T |
||||
| 0ヶ月 |
1ヶ月 |
3ヶ月 |
0ヶ月 |
1ヶ月 |
3ヶ月 |
|
| 0 7 15 30 |
65 65 78 95 |
95 90 78 100 |
95 95 78 90 |
43 46 60 70 |
65 65 60 75 |
65 70 60 60 |
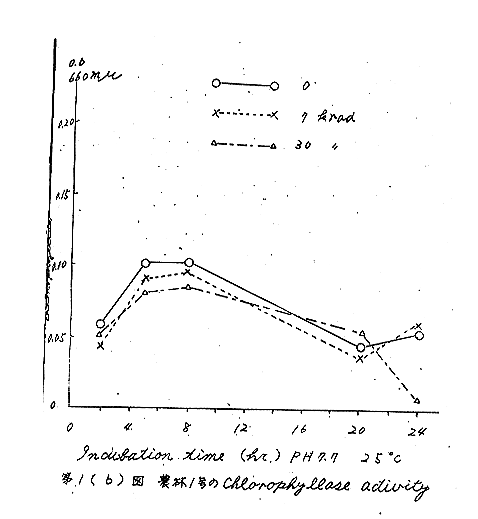
酵素活性が最も高い発芽期(貯蔵後3カ月)の結果を第1(a)、(b)図に示した。図のようにインキュベートの初期には、照射したものの方が低い傾向を示したが、これは量的に誤差値内に入るものである。
また、アセトン粉末の代わりにfresh tissue(クエン酸ソーダ溶液中でホモジナイズしたもの)を用いた場合も同様であり、ジベレリン溶液(5ppm)24時間浸漬したものでも変化はみられなかった。この酵素は、粗製で、かつ、アセトン溶液中でのみ活性を示すが、その反応は遅く、しかも精製するに従って、活性を失うので、検知法としては適当な方法とは思われない。
 |
 |
PeroxidaseはH2O2(2×10・E(−3)M)、Ascorbic acid(10・E(−6)M)、Catecholase はCatechol(5×10・E(−8)M),、ascorbic acid(2.5×10・E(−7)M)Cresolase はP−cresol(1×10・E(−4)M)、Ascorbic acid(1×10・E(−4)M)をそれぞれ基質として、馬鈴薯(男しゃく)の皮部および肉質部に分けてBenzidine色素法で測定した。Peroxide活性は皮部にみられ照射後1カ月(30krad)で非照射のものの約2倍に達し、2および3カ月後でもやや高い傾向を示したが、肉質部では活性は極めて低く、照射、非照射の間で判然とした差異は認められなかった。一方、Catecholaseおよびcresolaseは何れも皮部、肉部ともに照射、非照射間に有意差は認められなかった。
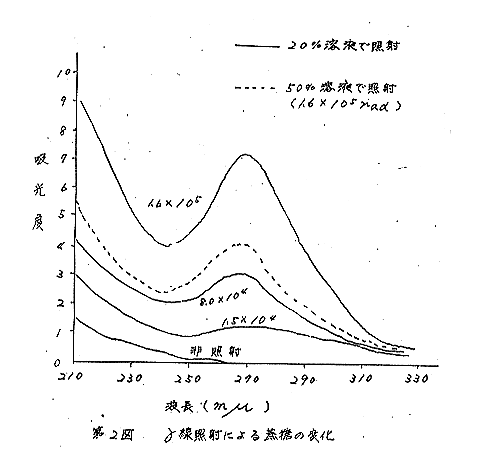
蔗糖(5%、20%)溶液に、γ線を1.5×10・E(4)、8.0×10・E(4)、1.6×10・E(5)rad,28℃で照射した基礎実験の結果を第2図に示した。
これは265〜270mμの間のグルコース、フラクトースなどの単糖類と一致するピークが、1.5×10・E(4)rad(15krad)で現れ、このピークは照射線量を増すに従って増大することを示している。また、濃度が稀薄な溶液で、radiolysisが増強されるかどうか確かめるために、5%及び20%溶液での照射結果を比較したが、この濃度では、20%溶液のradiolysisの方が大きかった。
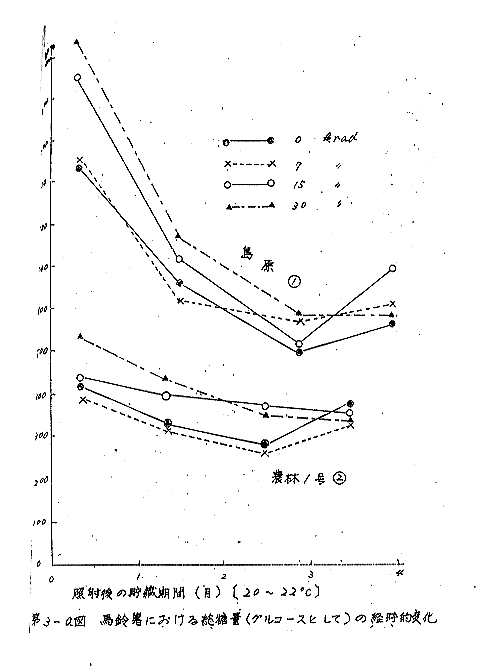
これらの結果から、照射により還元糖量が増加するものと推定し、照射後発芽(非照射群)または腐敗(照射群)がはじまるまでの期間の品種別による還元糖および非還元糖量の変化を第3(a),(b),(c)図に示した。総糖量(第3(a)図)は、照射後、3カ月以内では増加の傾向がみられたが、これは、とくに還元糖の増加によるものとは思われなかった(第3(b)図)。
貯蔵期間中の糖含量変化は農林1号(2、3)および男しゃく(4)は大体同じような傾向を示し、時期による変動が小さいのに対して、島原(1)では還元糖及び非還元糖ともに農林1号の約2倍量を含有し、時期による変動は著しかった。しかし、貯蔵後2カ月を経ると照射線量間に一定の傾向は認められなくなった。とくに品種や貯蔵期間の不明なものにあっては、糖の含有量の多少から照射の有無を推定することは不可能であると思われる。
また、deoxy sugarについては、蔗糖およびグルコースの20%水溶液に15、80、160krad照射したものおよび、照射馬鈴薯(男しゃく農林1号−7、15、30krad照射)そのもの、および、30krad照射馬鈴薯(男しゃく)から調製した澱粉中からは、いずれも検出できなかった。
 |
 |
 |
 |
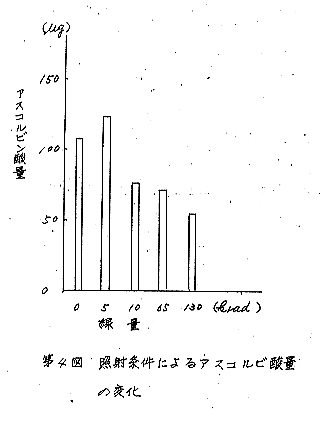
基礎的な実験として、アスコルビン酸5%メタ燐酸溶液(1.07γ/ml)を、あらかじめノーリットで酸化したものを小カップに2mlずつとり、次の条件で、Co−60によって照射した。各線量別による試料は、DNPH法で定量し、かつTLC上のスポットの位置を確認した。
照射によるアスコルビン酸の変化は第4図に示した。
また、TLC上にはアスコルビン酸およびdehydroascorbic acid と一致するスポット以外のものは検出されなかった。
なお、実際の条件とは異にして、予め酸化を行ったのは、実験の簡易化のためであり、また、ノーリットによる酸化は完全に酸化されるものではないが、臭素水やその他による酸化方法と比較するとき、この方法が最も安定した結果を得た。
しかし、第4図にみられるように、非照射のものより5krad照射したものの方が高い数値を示すのは、ノーリットで酸化されなかったアスコルビン酸が照射により酸化したものと思われる。この図から10kradでアスコルビン酸に変化があらわれるが、130kradの照射でも、約50%が残存するところから、アスコルビン酸自体は照射によって、それ程不安定のものではないようである。
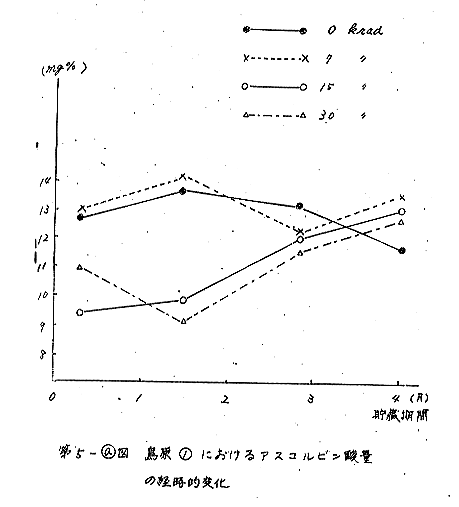
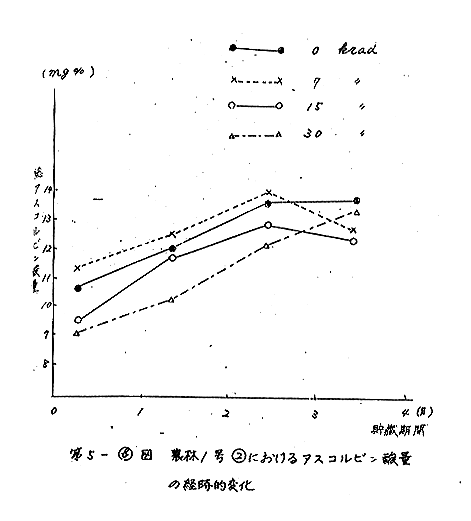
次に島原1、農林1号2について、照射後の貯蔵期間にみられるアスコルビン酸の変化を経時的に測定した(第5図)。両品種とも照射後、貯蔵期間の初期には非照射に比べ、アスコルビン酸含量は、低下の傾向を示すが、3カ月以後にはこの傾向はみられなくなった。しかし、7krad程度の照射では非照射のものと判別することは出来なかった。
また、男しゃく4でも、照射後1カ月で非照射試料が、13.7mg%を示すのに対し、30krad試料では6.6mg%の低い値であった。しかし、3カ月後には、非照射試料は発芽しはじめ、アスコルビン酸量は、11.2mg%を示したのに対し、30krad試料は15.0mg%と変わり、上記2品種と同様な経過を示した。
| 線 量 |
距 離 |
時 間 |
| 5 ×10・E(3) rad 1 ×10・E(4) rad 6.5×10・E(4) rad 1.3×10・E(5) rad |
10 cm 5.6 cm 2 cm 2 cm |
10 分 6 分 5 分 10 分 |
 |
 |
 |
男しゃく試料についてアルデヒド類、アンモニア態窒素、無機燐、tyrosine,gibberellic acidを分析した。また、蛍光灯下で2週間放置してchlorophyllの生成を検した。
アルデヒド類、アンモニア態窒素は照射、非照射の間で全く差異は認められなかった。また、無機燐、tyrosineは線量別間に大きな差異は認められなかった(第5表)。
Gibberellic acidについては、何れの試料からも検出できなかった。しかし、gibberellic acidの標品とはTLC上で一致しないが、蛍光を有するスポットを検出した。このスポットは30krad照射のものの方が非照射のものに比べて蛍光が強かったが、蛍光吸収曲線のパターンには、差異が認められなかった。
次に、馬鈴薯を通常の蛍光灯下に曝すとき、chlorophyll を生成する。この緑皮現象(Greening)は、γ線照射により抑制されるという報告があるが、照射後1ヶ月の試料では非照射および7krad照射試料を100とするとき、15および30kradの試料は55.3であった。しかし、貯蔵日数の経過とともに緑皮現象は不活発となる。また、ジベルリン処理、炭酸ナトリウム処理を施しても緑皮現象は促進されなかった。
| 線 量 |
pi (mg%) |
tyrosine (mg%) |
| 非 照 射、 芽 非 照 射、 塊茎 7krad 塊茎 15krad 塊茎 30krad 塊茎 |
30 14 16 19 20 |
28 52 52 51 70 |
これまでの照射馬鈴薯における研究結果から、γ線処理により明らかに変化するような酵素活性を測定する方法は、各個体別によりバラツキが大きいという点からも、照射、非照射の検知法としては適性を欠くように思われる。
一方、栄養成分の変化については、照射後、貯蔵期間が3ヶ月までは、非照射のものとある程度の数値的な差異は認められるが、これらは新しい成分の生成や、ある成分の消失といったものではなく、量的な増減にすぎないため、この数値が非照射と照射処理したものとの間で極端な差異がなければ検知法としての用をなさない。また、貯蔵期間が3ヶ月を過ぎると、その差異は認められなくなるので、この種の物質レベルでの検知法としては、現段階では不適当である。したがって、これからの問題として、γ線照射による発芽抑制が他発的休眠を与えるmaleic hydrazide tetrachloronitrobenzeneなどの化学薬剤による発芽抑制と共通した機構によるものか否か、また、差異があるものであるならば、いかなる点にあるのかを解明することが必要である。
また、γ線照射による発芽抑制機作が、休眠機構の延長ではなく、単に発芽細胞の破壊によるものと推定するならば組織学的に比較する検知法がより効果的であると考えられる。たとえば、形態学的検索は勿論であるが、組織切片上での化学的あるいは酵素学的反応を利用することによって、本報の結果をさらに詳細に解明しうるものと思われる。しかし上述した通り、組織学的検知法もまた、化学薬剤処理を施したものと比較検討することが必要となるものと考えられる。
1) J.Wohlgemuth.Biochem.Z.9,1(1908
)
2) O.A.Bessey et al.,J.Biol.Chem.,
164,321(1946)
3) S.Reitman et al.,Am.J.Clin.Path
.,28,56(1957)
4) M.Holden.Biochem.J.,78,359(1961
)
5) M.Somogyi,J.Biol.Chem.,195,19(1
952)
6) W,S.Waravdekar et al.,J.Biol.Ch
em.,234,1945(1959)
7) H.Hasselqist et at.,Acta Chem.S
cand.17,529(1963)
8) Strohecker.,Z.Lebensmittel.Fors
ch.,118,394(1963)
9) G.Ceriotti et al.,Bioch.,66,607
(1957)
10) J.Mestecky. Anal.Biol.,30,190(1
969)
11) J.Gordon et al., J.Agr.Food Che
m.,16,520(1968)
12) 中村道徳、農化、24、1(1950)
13) R.P.F.Gregory.,Biochem J.,101,5
82(1966)
(宮木高明、俣野景典、土田雅子、衛藤朝子、中村知子)
|
|