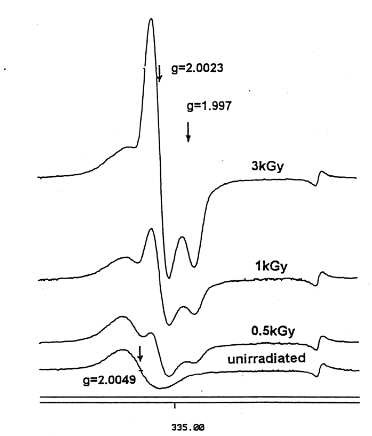
Fig.1 ESR spectra of irradiated (3 kGy,1 kGy,0.5 kGy)and unirradiated chicken bones.
 |
食品照射は、世界では、食品の保存などのために、現在他品目について許可されている。その中でも主として香辛料や乾燥野菜は、殺菌を目的に、実用的に照射されている。また、食鳥肉については、10数カ国で照射が許可されている。FDAは、1990年食鳥肉の病原菌の殺菌処理の目的で3kGyの照射を許可し、1993年9月からアメリカで食鳥肉が販売された。また、フランス、オランダでも商業的に照射されている。
照射食品の流通にあたっては、食品が照射されているかどうかを確認し、適切な表示を実施させるために、照射食品の検知法が必要である。この検知法の一つに電子スピン共鳴法(ESR法)がある。これは、照射によって食品中にできたフリーラジカルを電子スピン共鳴装置によって測定する方法である。骨の組織のように乾燥した結晶状態の部分には長期間安定なラジカルが生成するので、骨付きの畜肉・食鳥肉、卵殻、ピスタチオナッツ等に有効である。この方法は国際的にも各国で研究され、ブラインド試験等共同研究の成果が発表されている1)2)。
照射された線量を定量的に推定する方法に、線量付加法がある。これは、照射線量未知の試料の何段階の線量を付加的に照射したときの線量とラジカル量との関係をグラフで表し、そのラジカル量がゼロになる点を外挿して試料が照射された線量を推定しようというものである。この方法は、照射により、生成したラジカルが安定であることが前提であり、照射設備が不可欠である。現在、報告されている方法は3)4)、初期線量を処理された骨に照射している。またそれらの報告は、照射によって生成するラジカル量が飽和する線量の測定が必要であったり、データの数学的解析に関するものである。
筆者は、実際に貿易関係者や消費者の照射検知の試験のために、日本で簡便に対応できるように、都内のスーパーマーケットで購入した国産の骨付き鶏肉を用いて、ESR測定に必要な条件を検討し、さらにそれらの結果を踏まえて、線量付加法により線量の推定を試みた。
市販国産の手羽元鶏肉に、コバルト−60(60Co)線源(185TBq)を用いて、線量率0.5〜4kGy/hrで室温または低温でγ線照射を行った。その後これから骨を取り出し、骨幹中央部を切り取った。次に骨髄腔の骨髄及びスポンジ状の海面骨を削り取り、水洗・脱水乾燥させた。これをニンニクつぶし器、乳鉢等を使用して粉砕し、篩にかけ、一定の粒度とし、さらに一昼夜真空乾燥した。その約100mgをX-バンド用ESR試験管に入れ、日本電子(株)製電子スピン共鳴装置RE-2X型によりESR測定を行った。測定条件は、ESRシグナルが飽和しないように、中心磁場:335mT、掃引幅:7.5mT、モジュレーション幅:0.32mT、タイムコンスタント:0.03sec、掃引時間:4min、マイクロ波出力:1mWとした。
線量付加法の試料は、手羽元鶏肉に初期線量として一定線量照射後(3kGy、1kGy、0.5kGy、0.25kGy)、骨の処理をし、ESR測定を行った。その後、同一測定試料に対し、1kGy再照射−ESR測定を繰り返した。または、数個の照射試料を粉砕後、均一に混合・等分し、数段階の線量を同時に照射した。
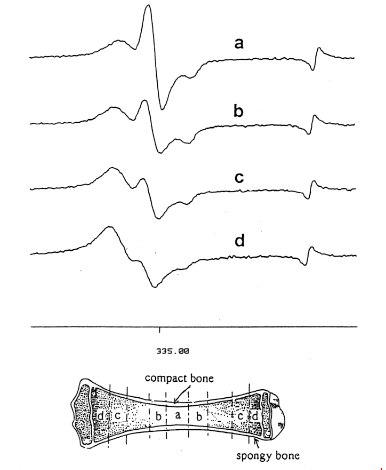
未照射、及び0.5kGy、1kGy、3kGy照射した骨のESRスペクトルをFig.1に示す。照射線量の大小に係わらず、g⊥=2.002 とg//=1.997(g値は不対電子の吸収位置を示す)の付近に主シグナルを持っている。これは骨の無機成分であるヒドロキシアパタイト(Ca10(PO4)6(OH)2)中に電子捕獲によって生じる5)。未照射試料にはこのシグナルは見られず、繊維状タンパク質であるコラーゲンのシグナル(g=2.005付近)が見られ、照射でできるスペクトルとは容易に識別できる。Fig.2に、1kGy照射した骨の部位によるスペクトルの違いを示す。コラーゲンは、骨端の軟骨部分に多く、骨の中央部の緻密骨には少ないことがわかる。
ラジカル量は一般にはピーク面積で表すが、この場合コラーゲンのピークを差し引かなければならず、煩雑である。そこでラジカル量を、g=2.002のピークからピークへの高さによるシグナル強度で表した。この方法でも、骨端を取り除き、骨幹中央部をよく削り取り、緻密骨を取り出したほうが誤差が少なくなった。
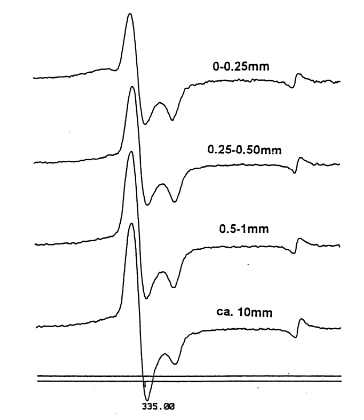
粉砕された骨の大きさによるスペクトルの違いをFig.3に、シグナル強度の違いをTable 3に示す。このように、粉砕による熱、摩耗からのラジカル消滅のためか、1kGy照射でも、3kGy照射でも細かく粉砕されたものほどシグナルは小さかった。スティック状(約1cm)のものはg//のシグナルが小さくなった。粉砕した試料でも試料形状が大きいほど、g//のシグナルが小さくなった。ESR測定時に、試料の結晶軸やラジカル分子軸と磁場の方向との角度によって異なるg値を示す場合、多結晶や粉末のスペクトルは雑多な方向に向いた微結晶のESRスペクトルの重ね合わせとなる6)。そのため、このようなスペクトルの違いがでてくる。スティック状の試料は、内径3.6mmのXバンド用ESR試料管へ入れる作業性も悪い。
同一試料で10回ESR測定を繰り返した場合の試料の大きさによるシグナル強度の変動を調べた。その結果、3kGy照射の場合、粉砕した試料の大きさが1〜2mm(16-8.6mesh)では測定の変動係数は約5%、1mm以下でのもので変動係数は約3%で、粗いほどESR測定値のばらつきが大きくなることがわかった。1kGy照射では、変動係数は1〜2mmの物も1mm以下の物も約5%であった。ESR測定の誤差から考えても変動係数が5%は、測定には十分であると考えられる。試料の大きさが細かい程、試料管内での試料の位置の差による誤差を小さくすることはできるが、細かくするには、摩擦熱等の影響を除くために、凍結粉砕する必要があり、粉砕する労力を考えても、試料の大きさは1〜2mmが妥当と思われる。
ESR装置のキャビティー有効測定部は4.3cmであるが、磁場の均一性を考えると、試料管で約1cmの高さが最適である。この試料量は、骨の密度にもよるが、約100mgに相当する。
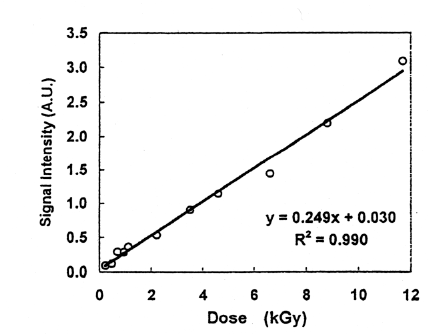
同一時に購入した試料に、同時に同一線量照射しても、ESRシグナル強度は異なり、個体差が大きいことがわかった。骨の密度、結晶性が鶏の生物学的変動(血統、性別、食餌状況、年齢等)で異なり、個体差となるといわれている7)。そこで、照射後同一の骨を粉砕し、混合・均等に分取した4試料のESRを測定した。Fig.4に、このように測定したシグナル強度の平均値と照射線量の関係を示す。ESR法の検出限界は50Gyとも100Gyともいわれているが8)9)、0.23kGyから12kGyの範囲では、線量とシグナル強度間に相関係数r=0.995で、よい直線関係が認められた。
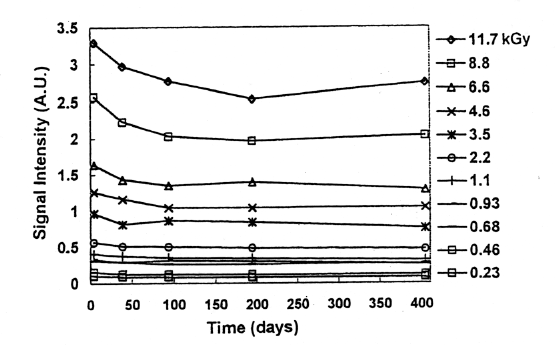
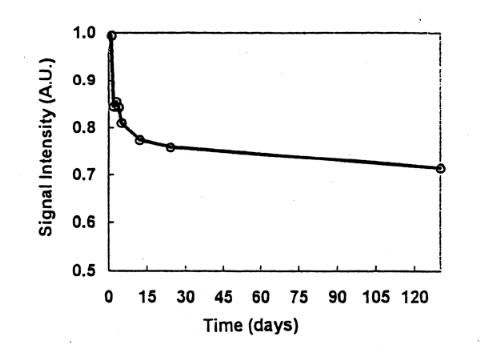
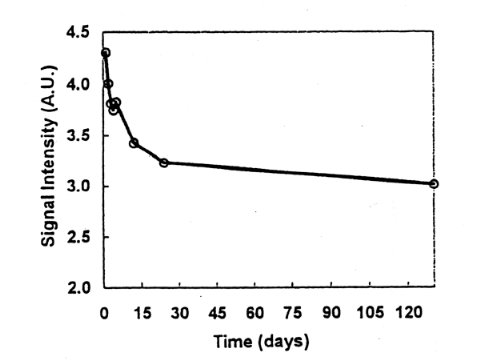
Fig.5には、肉に照射後、骨の処理、ESR測定をし、その後ESR管に入れたまま乾燥状態で室温保管して、経時変化を調べた結果を示す。照射後400日経過した試料では、シグナル強度は照射後4日経過の値に対して、85から75%の範囲になり、平均して80%前後に減少していた。また照射直後の経時変化を見るために、骨の状態で照射し、粉砕後同一試料から分取した2または3試料の平均のシグナル強度をFig.6,Fig.7に示す。照射直後のESR測定値と比較して、照射後数日間で10〜15%、1か月で25%、数ヶ月で30%近く減少した。その後は比較的安定した。また冷凍肉の状態で保存した試料のシグナル強度の変化を調べた。この場合比較した試料は、異なる個体試料となるが、2年経過した試料はほとんど同じ値を示した。
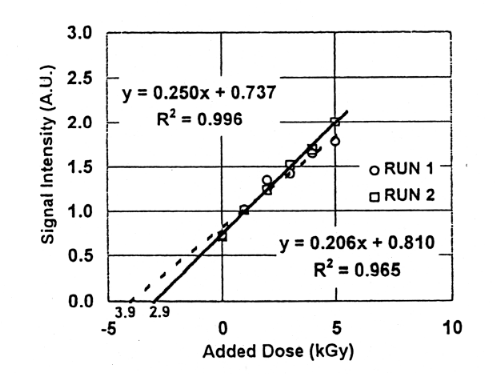
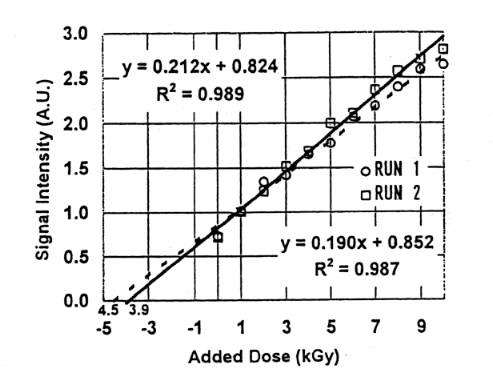
Fig.8に、骨付き鶏肉に3kGy照射、骨の処理をして、骨の粒子を2区分に分けESR測定をし、その後その各々に1kGy再度照射及びESR測定を繰り返した線量付加法の結果を示す。その結果、3.9kGy、2.9kGyとかなり異なった値を示した。この場合は、照射とESR測定を繰り返し行うために、ESR管から試料を出し入れしている。そのため測定時には、その都度試料位置が異なり、それが測定値の変動の原因になっていると思われる。
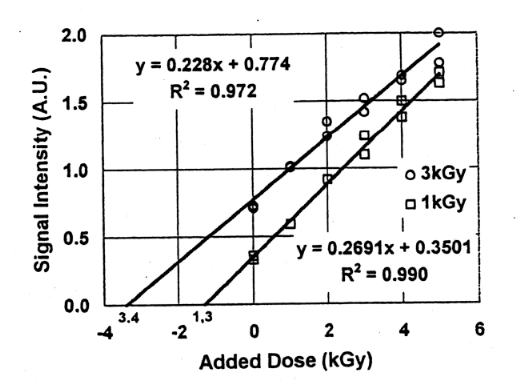
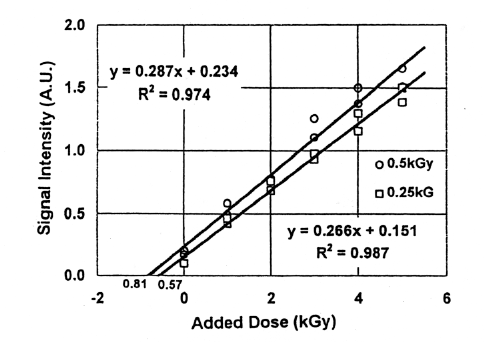
Fig.9はFig.8と同じ試料にさらに1kGy照射を同様に繰り返し10kGyまで線量を付加した結果である。Fig.8の結果と比較すると、3.9kGyが4.5kGyに、2.9kGyが3.9kGyとなり、初期線量が3.0kGyの約1.5倍になった。実際的には、初期線量が不明の場合、再照射後の総線量が高線量になることもある。高線量照射した場合、ラジカル量と線量との関係は直線性が失われ、飽和してくる8)。このことから、また照射の煩雑さから考慮しても、付加線量は5kGy程度までとし、この範囲で1次回帰直線を適用することが簡便であると思われる。また多試料の測定結果を適用するとこによって試料の個体差の影響を軽減できると考える。Fig.10.、Fig.11に2試料の平均値から求めた線量付加法の結果を示す。3.0kGy、1.0kGy、0.5kGy、0.25kGy照射した試料に5kGyの線量付加法を適用したところ、3.9kGy、1.3kGy、0.81kGy 、0.57kGyの値を得た。初期線量が小さいほど誤差は大きい。
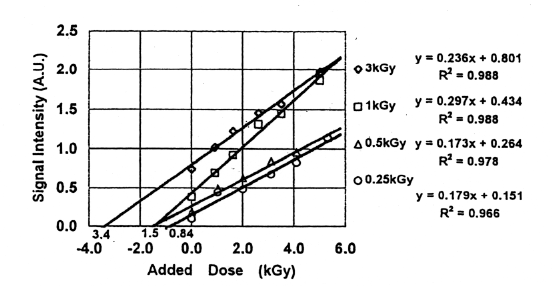
前途のように、室温で放置した骨の照射直後の経時変化が大きいので、この方法は照射後ESR測定するまでの期間を一定にする必要がある。さらに線量を付加する毎に照射しなければならず、時間がかかる。そこで、いくつかの試料を均一に混合してから異なる線量を同時に照射した。Fig.12は初期線量が、3.0kGy、1.0kGy、0.5kGy、0.25kGyのものの2から4試料の平均の測定結果を線量付加法に適用したもので、3.4kGy、1.5kGy、0.84kGyの値を得た。Fig.10、Fig.11の結果と比較すると、1.0kGy以下の線量では、同時照射の場合のほうが誤差が大きいことがわかった。
上記の結果から、次のことが結論づけられる。ラジカル量を、ピークからピークへの高さで表し、試料の調整は、骨端を取り除き、骨幹中央部をよく削り取り、緻密骨を取り出したほうが誤差は少なくなる。試料の大きさは、粉砕する労力を考えても、1〜2mmが妥当である。ESR装置の磁場の均一性を考えて、試料量は約100mgが適当である。個体差の影響をなくすために、同一の骨試料から分取した多数の試料の統計的手法を適用して解析する。線量付加法による照射線量推定の際にはESR測定や照射の誤差、測定条件を一定にする必要性、照射施設、実験時間が長い等のため、実用的には、付加線量は5kGy程度までとし、この範囲で1次回帰直線を適用する方法が、おおよその推定には適当であると思われる。さらに、最初の照射から線量付加法を適用した時点まで、どのような状況で貯蔵されていたか等の、経過が不明の試料では、シグナル強度の経時変化を考えると、推定線量の誤差は大きくなる可能性がある。
文献
1)M.F.Desrosiers:Appl.Radiat.Isot.,47,1621-1628(1996).
2)M.F.Desrosiers et al.:Int.J.Food Sci.Tschnol.,29,153-159(1994).
3)M.F.Desrosiers et al,:Appl.Radiat.Isot.,44,439-442(1993).
4)F.Bordi et al.:Radiat.Phys.Chem.,43,487-491(1994).
5)K.Ostrowski et al.:Free Radicals in Biol-ogy,4,321-344(1980).
6)池谷元伺:ESR(電子スピン共鳴)年代測定、アイオニクス(19987).
7)R.Gray et al.:Radiat.Phys.Chem.,35,284-287(1990).
8)J.S.Lea et al.:Int.J.Food Sci.Technol.,23,625-632(1988).
9)M.F.Desrosiers et al.:J.Agric.Food Chem.,36,601-6036(1988).
|
A: Day of irradiation. B: Day of measurement of signal intensities. a,b: Part of bone shown in the figure in Fig 2. |
| A |
5/26 |
9/11 |
||
| B |
9/5 |
9/14 |
||
| Dose |
1.0kGy |
3.0kGy |
3.2kGy |
3.2kGy |
| Part of bone |
a |
a |
a |
b |
| Particle size |
Signal intensity |
|||
| 0-0.25 mm |
0.29 |
0.71 |
- |
- |
| 0.25-0.5 mm |
0.34 |
0.74 |
- |
- |
| 0.5-1 mm |
0.44 |
0.91 |
1.21 |
1.02 |
| 1-2 mm |
- |
- |
1.29 |
1.12 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
|
|