Table 1. Radiation-induced hydrocarbons from main fatty acids.
 |
2.1 試料調製・照射
2.1.1 電子線照射試料
2.1.2 γ線照射試料
2.2 炭化水素の定量
2.2.1 試薬
2.2.2 炭化水素の抽出・分離
2.2.3 炭化水素の同定
2.2.4 GC による炭化水素の分離・定量
2.2.5 炭化水素の分析精度の確認
2.2.6 炭化水素の回収率
3.1 電子線照射試料における深さと炭化水素生成量の関係
3.2 炭化水素生成量の線量依存性
3.3 炭化水素生成量に対する温度影響
3.4 炭化水素の生成比
3.5 照射の判定
食肉および肉加工食品への放射線照射処理は、大腸菌 O-157 やサルモネラ菌による食中毒対策として注目されている。米国食品医薬品局 (FDA) は 1999 年 12 月食肉照射を承認し、「照射済み」の表示を義務づけた。また、米国農務省/FSIS は実施規則を制定し、2000 年 2 月から施行された。これにより 10MeV の電子線照射施設が稼動し、冷蔵冷凍肉の電子線照射が行われ、市販されている。この影響が肉をはじめとする食品の輸入国である日本に及ぶことが懸念され、検知法が求められている。
米国での照射ハンバーグを想定し、γ線照射鶏肉で検討してきた化学的検知法1) を適用し、電子線を照射した牛挽肉に対して炭化水素法による検知を検討した。電子線照射はγ線と異なり、照射効果が試料の厚さに影響するためサンプリング方法も検討した。
試料は脂身の多いブロック肉 (オーストラリア産) を浦和市内のスーパーマーケットで購入し作成した。大まかに切ったブロック肉をブレンダで細かくし、挽肉とした。この挽肉の比重は 1.0、含水率 39%、脂肪分 21% であった。
1 試料当たり約 120g を直径 70mm、高さ 30mm の金属の型に空気が極力入らないように詰めた。 金属の型に詰めた試料は、型を抜き、円柱状の挽肉とし、これをシャーレにのせ、発泡スチロールの箱に入れた。照射時の発熱により脂肪などが飛散しないよう発泡スチロールの箱の上部をフィルムで覆った。これらの試料を厚さ 3cm のダンボールを敷いたカートに乗せ、片面照射した。照射は室温で行い、照射終了時の試料温度は 25℃ であった。
使用した電子線加速器は出力 5MeV で照射条件は次のとおりであった。
| 線量 | ビーム電流値 | コンベアベルト速度 |
| 5.1kGy | 5.61mA | 15.0m/分 |
| 10.2kGy | 5.44mA | 7.5m/分 |
本研究における電子線の線量はダンボールを敷いたカート上 3 箇所に線量計を置いて照射施設側で測定した平均値を用いた。
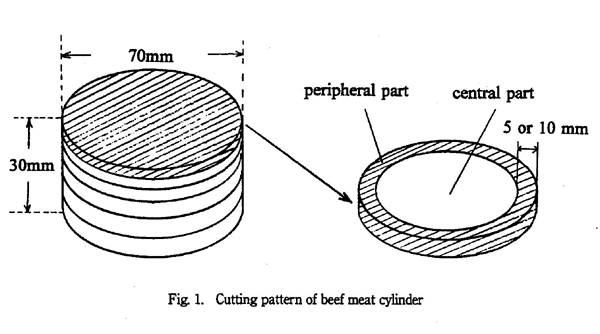
電子線を照射した試料は再び金属の型に入れ、上下をシャーレで挟み冷凍庫に保管した。炭化水素を分析するときに、冷凍庫から試料を取り出し約 30 分間室温に放置し、金属の型から試料を凍ったまま取り出した。Fig. 1 のように、凍った試料を上部は薄めに (約 3mm)、下部は厚め (5 〜 11mm) に、ステンレス包丁で切り分け、6 〜 7 枚の円盤状にした。試料中心部と外周部では電子線の照射状況に差があることが予想される。このため、円盤状に切れ分けた試料の外周をさらに幅 5mm(5.1kGy の場合)、または 10mm (10.2kGy の場合) 程度、解剖用鋏で切り取った。円盤状に切り分けた試料の外周を「外側」、残りを「中心部」とした。
切り分けた試料の厚さ (深さ) は、水平に切り分けた円盤状の試料の重さから比例配分し、それぞれ算出した。これらの厚さ (深さ) の中心を深さの代表点として、実験結果をまとめた。
炭化水素生成量に対する照射温度の影響を調べるため、温度の制御をしやすいγ線を照射して試料を作成した。牛脂 (和牛) を共栓試験管に入れ、185TBq コバルト 60 (60Co) の線源で照射した。照射時の温度は室温 : 18.5℃ (18.0 〜 19.0℃)、氷冷 : 0℃、氷と塩化ナトリウムの寒剤で冷却 : -17.7℃ (-17.4 〜 -18.0℃) であった。この時の線量率は 2.63kGy/h であった。
European Committee for Standardization の標準法 (炭化水素法)2) に若干の改良を加えた方法で定量した。
以下、炭化水素を括弧内に示したように記す。
2.1.1 で切り分けた試料 (5 〜 30g) と無水硫酸ナトリウム (10 〜 30g)、または 2.1.2 で照射した牛脂 (5 〜 7g) と無水硫酸ナトリウム 15g を、250ml フラスコに入れヘキサン 80ml とともに約 1 時間還流して脂肪を抽出した。このヘキサン溶液を 100ml 共栓付試験管に移し、新鮮なヘキサンを添加し全量を 100ml とした後、無水硫酸ナトリウム (10g) を加え、一晩放置した。
105℃ で乾燥し、恒量にした蒸発皿にヘキサン抽出液 5ml を入れ、ヘキサンを自然蒸発させた。次いでこの蒸発皿をデシケータ中で 30 分間減圧乾燥した。空の蒸発皿重量とヘキサンを蒸発・乾燥した蒸発皿重量の差から、ヘキサン抽出液 5ml 中の脂肪含量を求めた。
脂肪 1g に相当するヘキサン抽出液を分取し、ロータリー・エバポレータを使用して (40℃、約 25kPa、以下同じ条件)、数 ml にまで濃縮した。γ線を照射した牛脂 (和牛) では炭化水素の回収状況を確認するため、標準物質 (C13:0 と C14:0) を 4μg 添加して濃縮した。濃縮液に内部標準溶液 (2.0μg/ml の C20:0) を 1ml 加え、フロリジルカラム (直径 20mm、フロリジル 20g) に添加した後、ヘキサンを 1 分間に 3ml の速さで流下させ炭化水素を分離した。初出の流出液 60ml をロータリー・エバポレータを用いて数 ml に濃縮した後に、窒素ガスを吹き付けて 1ml にまで濃縮し、ガスクロマトグラフ質量 (GC/MS) 分析及び GC 分析の試料とした。
炭化水素の同定は、ヒューレットパッカード製 GC/MS (5890 シリーズ 2/5971) を用い、J&W 製キャピラリーカラム DB5 (長さ約 12m、内径 0.2mm、膜厚 0.33μm) により GC/MS 分析を行なった。キャリアガスはヘリウム (1ml/分、コンスタントフローモード)、試料注入量は 1.0μl でスプリットレス条件で測定した。注入口温度は 230℃、検出器は MSD (スキャンレンジ : M/Z 50 〜 500) を用いた。イオン化法は EI、イオン源温度は 270℃ とした。オーブン温度は 55℃ で 2 分保持し、155℃ まで 10℃/分、200℃ まで 4℃/分、270℃ まで 15℃/分で昇温した。
このようにして得られた試料の GC/MS のクロマトグラムを標準物質の保持時間、分子イオンピーク、フラグメントイオンと比較し、それぞれの炭化水素を同定した。
島津製作所製 GC-17A (検出器 : FID) を用い、J&W 製キャピラリーカラム DB5 (長さ 25m、内径 0.2mm、膜厚 0.33μm) により GC 分析を行った。キャリアガスはヘリウム (流速 : 約 1ml/分)、試料注入量は 1.0μl でスプリットレス条件で測定した。注入口温度は 200℃、検出器温度は 250℃ とした。オーブン温度は 55℃ で 2 分保持した後、155℃ まで 12℃/分で昇温し、さらに 230℃ まで 5℃/分で昇温し、230℃ で 10 分保持した。
各炭化水素は標準物質の保持時間を対照として同定し、その量は C20:0 を用いて内部標準法で求めた。ヘキサン 1ml 中に 2.2.1 に記した標準物質を各々 0.1 〜 20.0μg と 2.0μg の内部標準 (C20:0) を混合した標準液を GC で分析し、その面積値から各々の炭化水素について、検量線を作成した。これらの検量線の相関係数は R2 = 0.9910 〜 0.9999 であった。
この分析法の定量下限値は 0.07μg/g (脂肪) とした。未照射試料から C14:0、C15:0、C17:0 の 3 種の炭化水素が 0.1 〜 0.6μg/g (脂肪) 程度定量されたが、不飽和炭化水素の 1-C14:1、1,7-C16:2、1-C16:1、8-C17:1 は検出されなかった。実試料を用いて検知する場合には、バックグラウンドの炭化水素量を定量できないため、分析結果を解析する際、バックグラウンドの補正をしていない。
分析精度を確認するため、1ml のヘキサンに各炭化水素を 0.1μg または 0.2μg と内部標準 C20:0 を 2.0μg を含む標準液を調製した。これらの標準液を GC (FID) で 5 回繰り返し測定した。この結果、標準液中の各炭化水素濃度が 0.1μg/ml の場合は変動係数 (標準偏差÷平均値×100) が 1.4 〜 3.8%、0.2μg/ml の場合は 0.7 〜 1.9% であることが分かった。
未照射の挽肉 20g に炭化水素の標準液と無水硫酸ナトリウム 20g を加え、2.2.2 と同様に脂肪を抽出・分離した。脂肪 1g に対して 1.4 〜 1.9μg の炭化水素を添加したとき、回収率は 94 〜 125% であり、脂肪 1g に対して 7.7 〜 9.4μg の炭化水素を添加したとき、回収率は 86 〜 91% であった。
これらの回収率は炭化水素の分子量の小さいもの程低くなる傾向があった。この原因を調べたところ、抽出した脂肪溶液を濃縮する過程、およびフロリジルカラムにかけた後ヘキサンを濃縮する過程に注意する必要があった。この 2 つの過程で、過度に濃縮すると、生成した炭化水素のうち分子量の低いものほど失われやすいことが確認された。
炭化水素の生成比を検討するためには、高い回収率を維持し、炭化水素生成量を正確に定量する必要がある。このためγ線を照射した試料では、すべての脂肪溶液に分析対象とした炭化水素のうち最も分子量の低い 1-C14:1 に近い C13:0 と C14:0 を 4.0μg/g (脂肪) 添加し、回収状況を確認した。回収率の低いデータを除外して解析したデータの回収率は、C13:0 で平均 105 (79 〜 125) %、C14:0 で平均 111 (87 〜 128) % であった。電子線を約 5kGy 照射した試料では C13:0 が約 0.6μg/g (脂肪)、C14:0 が約 0.4μg/g (脂肪) 生成した。γ線でも同じ程度 C13:0 と C14:0 が生成していると推定されるので、実質の回収率は C13:0 で平均 90%、C14:0 で平均 101% であった。電子線照射した試料でも、γ線を照射した試料でも、回収率で補正はしていない。
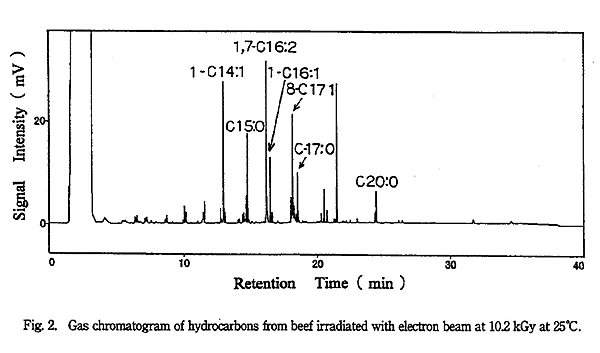
脂肪に放射線を照射したとき生成する主な炭化水素と、もととなる脂肪酸の関係3) を Table 1 に示す。炭素数が脂肪酸のそれより 1 少ない炭化水素 (Cn-1:0) と炭素数が 2 少なく不飽和度が 1 増えた炭化水素 (Cn-2:1) が多く生成する。以下、これらの炭化水素を Cn-1:0、Cn-2:1 と記す。牛肉の脂肪に多く含まれる 3 種類の脂肪酸から生成する Table 1 の 6 種類の炭化水素を同定・定量した。これらの炭化水素は Fig. 2 に示すとおり GC 分析で良好に分離できた。
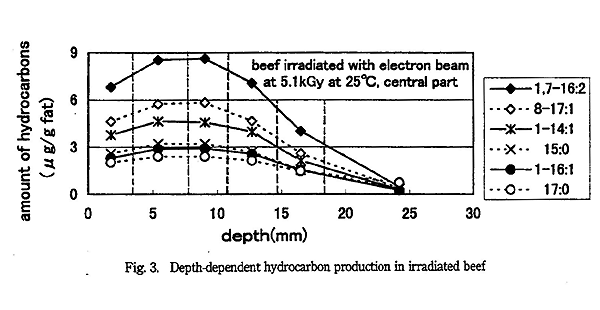
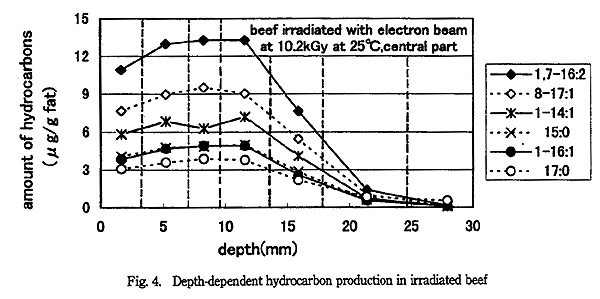
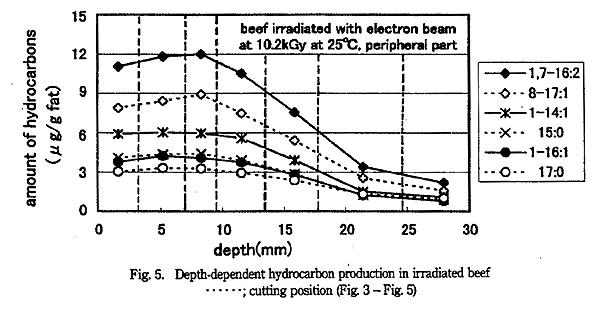
円柱状の塊の牛挽肉に電子線を照射したときの深さと炭化水素生成量の関係を Fig. 3 〜 5 に示す。Fig. 3 は 5.1kGy 照射し、切り分けた中心部の結果である。 Fig. 4 は 10.2kGy 照射し、切り分けた中心部の結果である。Fig. 5 は 10.2kGy 照射し、切り分けた外側の結果である。
牛挽肉中心部の炭化水素生成量 (Fig. 3 と 4) を比較すると、生成量は線量によらず表面より 7 〜 10mm 程度のところが最大となり、深くなるにつれ生成量が低下した。それぞれの試料で炭化水素生成量を表層の値と最大値を比較すると、その比は 1.2 〜 1.3 であった。5MeV の電子線を水に照射した場合の深度線量分布曲線の計算4) では、線量の最大値は深さ約 12mm で、表面での値と最大値の線量の比は 1.6 である。本研究では、3 〜 4mm の厚さを持つ試料で比較しているので、この厚さの試料中に生成した炭化水素量の平均値を比較している。このため、炭化水素生成量について表層の値と最大値を比較すると 1.6 より小さくなったと推定される。炭化水素生成量の最大値の深さが予想より浅いのは、炭化水素を分析できる厚さに試料を切り分けると数 mm の厚さが必要なため、理論通りにならなかったと考えられる。
10.2kGy 照射した試料の中心部と外側で炭化水素生成量を比較する (Fig. 4 と 5) と、深さが 0 〜 10mm 程度のところでは、生成量がほぼ同じか中心部の方が数〜 20% 多かったが、分析誤差を考えると中心部と外側でほぼ同じである。深さが 20 〜 30mm 程度のところでは、中心部より外側の方が炭化水素生成量が多かった。これは外側では斜め横方向からの電子線の影響等を受けたと考えられる。
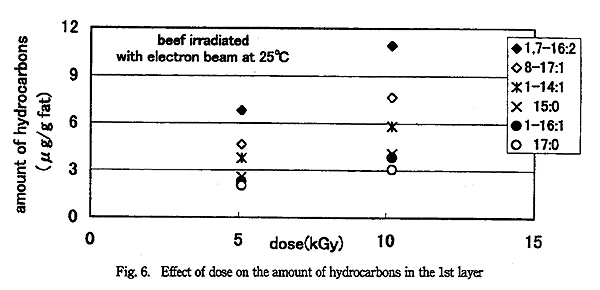
電子線照射した牛挽肉の一番上の層 (約 3mm・内側) の炭化水素生成量を 5.1kGy 照射した場合と 10.2kGy 照射した場合で比較すると、Fig. 6 のようになった。線量が 2 倍になっても、炭化水素の生成量は 1.5 〜 1.7 倍であった。1 回の分析では誤差の影響が大きいことも考えられるので、上から約 10mm の試料 (n=3) の平均で比較しても、炭化水素の生成量は 1.5 〜 1.7 倍であり、線量と炭化水素生成量は比例しなかった。
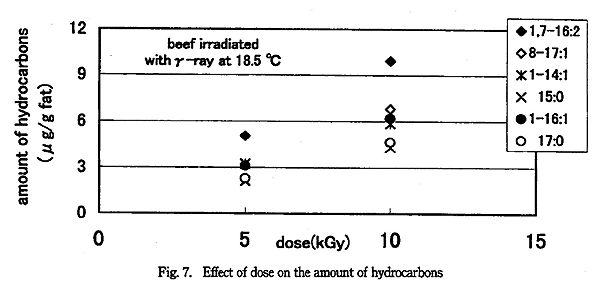
しかし、脂肪に放射線を照射したとき生成する炭化水素の量は線量に依存すると報告されている3)。線量管理をしやすいγ線を照射した牛脂の場合、炭化水素生成量は Fig. 7 のとおりであった。線量が 2 倍のとき、炭化水素の生成量は 3 回測定した値で 1.8 〜 2.1 倍になり、線量依存性を確認出来た。
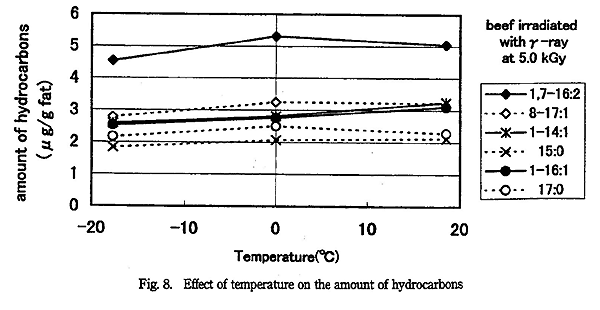
脂肪に放射線を照射したとき生成する炭化水素の量は照射温度が低くなる程減少することが報告されている5)。そこで温度影響をγ線を照射した牛脂で検討した。その結果を Fig. 8 に示す。1 条件に付き 3 試料を分析したところ、結果にばらつきがあったが、照射温度が高くなるほど炭化水素の生成量は増える傾向があった。
European Committee for Standardization の標準法 (炭化水素法)2) では、放射線の照射によって生成される炭化水素がノイズの 3 倍以上のピークとして検出されることを前提にし、炭化水素生成比の実測値と予測値を比較し、照射の有無を判定するとしている。しかし、予測値の計算方法、実測値と予測値の誤差範囲が明示されておらず、この標準法によって照射の有無を判定するのは困難である。
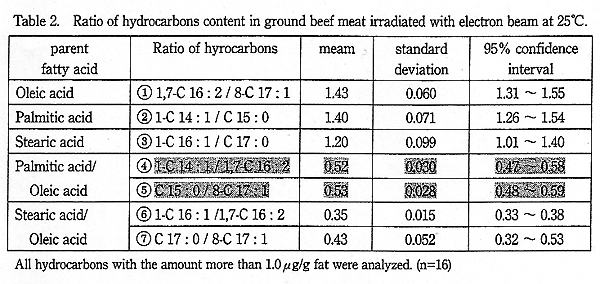
Table 1 に示す炭化水素の一部はバックグラウンドとして存在するが、Schreiber ら6) は放射線照射によって生成した炭化水素はそれぞれが一定の割合になると報告している。牛肉において、このことを確認するために、電子線照射による炭化水素生成量から生成比を Table 2 にまとめた。この表は分析誤差やバックグラウンドの影響が少ないと予想される全ての炭化水素生成量が 1.0μg/g (脂肪) 以上のデータに基づいている。
炭化水素生成比の等しいものを推定するために、生成比について平均値の差の検定を行った。オレイン酸由来の 1,7-C16:2/8-C17:1 (Table 2 の ①) とパルミチン酸由来の 1-C14:1/C15:0 (Table 2 の ②) の量比について平均値の差の検定を行うと、危険率 5% で有意差はなかった。しかし、これらの量比とステアリン酸由来の量比について平均値の差の検定を行うと、それぞれ有意差 (危険率 5%) があった。
異なる脂肪酸由来の Cn-2:1 の量比と Cn-1:0 の量比では、パルミチン酸由来とオレイン酸由来の Cn-2:1 の量比 1-C14:1/1,7-C16:2 (Table 2 の ④) と、Cn-1:0 の量比 C15:0/8-C17:1 (Table 2 ⑤) 量比について、平均値の差を検定したところ、危険率 5% で有意差はなかった。しかし、ステアリン酸由来とオレイン酸由来の Cn-2:1 の量比 1-C16:1/1,7-C16:2 (Table 2 の ⑥) と、Cn-1:0 の量比 C17:0/8-C17:1 (Table 2 の ⑦) について、平均値の差を検定したところ、危険率 5% で有意差があった。この 2 つの量比に有意差があったのは、C17:0 が未照射試料から検出されるため、Cn-1:0 の量比 (C17:0/8-C17:1) が見かけ上やや大きくなっていることによると思われる。
これらのことから、室温で牛挽肉に電子線を照射したとき炭化水素の生成比は、(1) 、(2) 式のように推定される。
1-C14:1/1,7-C16:2 = C15:0/8-C17:1 ・・・・・ (1)
(Table 2 の ④ と ⑤)
1-C14:1/C15:0 = 1,7-C16:2/8-C17:1 ・・・・・ (2)
(Table 2 の ② と ①)
(1) 式の両辺に 1,7-C16:2/C15:0 を掛けると (2) 式になり、(1) 式と (2) 式は数学的に同等である。よって (1) 式について考察すると、Schreiber らはこの比は脂肪酸の組成比と同じと報告している6)。
1-C14:1/1,7-C16:2 ≒ C15:0/8-C17:1 (Table 2 の ④ と ⑤)
≒ 脂肪酸の比(パルミチン酸/オレイン酸)・・・・・ (1')
脂肪酸の組成を分析せずに照射の有無を判別するには、照射した牛肉に対して (1') 式の値がどのような範囲になるか検討するのが有用と考える。
Schreiber ら6) は、2.5 〜 3.5kGy と 6.7 〜 7.5kGy 照射した牛肉試料を 17 ヶ所もの研究機関で分析した数多くの結果を解析した。この報告では脂肪酸の組成を分析し、パルミチン酸/オレイン酸の組成比は 0.55 であった。このとき、1-C14:1/1,7-C16:2 (Table 2 の ④) の平均が 0.6、標準偏差 0.2 であり、C15:0/8-C17:1 (Table 2 の ⑤) の平均が 0.7 で、標準偏差 0.3 であった。Schreiber らの量比の 95% 信頼区間を計算すると 1-C14:1/1,7-C16:2 (Table 2 の ④) が 0.2 〜 1.0 で、C15:0/8-C17:1 (Table 2 の ⑤) が 0.1 〜 1.3 である。これらの結果を参考にすると、(1') 式の値は Schreiber らのいずれもの量比の 95% 信頼区間程度すなわち、0.2 〜 1.0 と考えるのも一案である。
迅速な検知を行うために脂肪酸の組成を分析せずに判定できることが望まれる。 そこで、本研究では、牛の種類毎、部位別に脂肪酸組成が収録されている日本食品脂溶性成分表7) の値を参考にした。この表によると、牛肉中のオレイン酸 (FA18:1) 43 〜 51%、パルミチン酸 (FA16:0) 23 〜 29%、ステアリン酸 (FA18:0) 9 〜 14% である。収録されている脂肪酸組成から、それぞれの牛肉中の脂肪酸の比を計算すると、パルミチン酸/オレイン酸の比は 0.47 〜 0.66 である。
γ線を照射 (5.0kGy、10.0kGy) した牛脂 (和牛) に生成した炭化水素を分析した結果 (試料数=12) では、1-C14:1/1,7-C16:2 (Table 2 の ④) の量比が 0.49 〜 0.69 (平均 ; 0.58) であり、C15:0/8-C17:1 の量比が 0.55 〜 0.73 (平均 ; 0.65) であった。これらの値は脂肪酸の組成が多少異なるためか、電子線を照射した Table 2 の結果よりやや大きかったが、0.2 〜 1.0 の範囲には入った。
電子線を照射した試料のうち炭化水素の生成量が少ない試料は分析誤差が大きいと思われるが、バックグラウンドから検出されない炭化水素の量比 1-C14:1/1,7-C16:2 (Table 2 の ④) は 0.49 〜 0.60 と脂肪酸の組成比に近かった。一方、バックグラウンドからも検出される Cn-1:0 を含む C15:0/8-C17:1 (Table 2 の ⑤) などの比はばらついた。実際的な検知を考えると、オレイン酸とパルミチン酸から生成する 8-C17:1、1,7-C16:2 と 1-C14:1、C15:0 が定量され、1-C14:1/1,7-C16:2 (Table 2 の ④) の量比が脂肪酸の組成比に近ければ、照射されたと判別できる。
以上のことから、生の牛肉について照射の有無を判別するには、
① 含有量の多い脂肪酸 (オレイン酸とパルミチン酸) から生成する Cn-1:0 と Cn-2:1 が定量される。
② 1-C14:1/1,7-C16:2 (Table 2 の ④) の値がパルミチン酸/オレイン酸の組成比 (0.47 〜 0.66) に近い。
この ① と ② の条件を満足すれば、照射されたと判別できる。さらに、
③ C15:0/8-C17:1 (Table 2 の ⑤) の値がパルミチン酸/オレイン酸の組成比 (0.47 〜 0.66) に近い。
③ の条件も満足すれば、明確に照射されたと判別できる。
円柱状の牛挽肉に 5MeV の電子線を片面照射し、照射方向に対して垂直に、脂肪が 1g 程度含まれるように切り分け、それぞれの部分の炭化水素生成量を定量した。この結果、炭化水素生成量は表層より深さ 7 〜 10mm 程度のところが最大になり、試料の内側では、深さ 25 〜 30mm のところではほとんど検出されなった。このように、電子線を牛挽肉に照射したときの炭化水素生成量 (中心部) と試料の深さは、計算した深度線量分布曲線4) に近かった。しかし、試料の外側では深さ 20 〜 30mm のところでも、照射の影響が認められた。電子線を照射した牛挽肉では、試料を切り分けて炭化水素生成量を分析することにより、理論どおり線量が分布することを確認できる。
脂肪に電子線またはγ線を照射したとき、炭素数が脂肪酸のそれより 1 少ない炭化水素 (Cn-1:0) と炭素数が 2 少なく不飽和度が 1 増えた炭化水素 (Cn-2:1) が多く生成する。照射の有無を判別するには、牛肉の主な脂肪酸であるオレイン酸とパルミチン酸から生成する主な炭化水素を定量する。1-C14:1/1,7-C16:2 (Table 2 の ④) と C15:0/8-C17:1 (Table 2 の ⑤) 量比が脂肪酸の組成比 (0.47 〜 0.66) に近ければ、照射されたと明確に判別出来る。本研究では、1-C14:1/1,7-C16:2 (Table 2 の ④) は平均 0.52 (0.45 〜 0.56)、C15:0/8-C17:1 (Table 2 の ⑤) は平均 0.53 (0.49 〜 0.60) と、これらの量比は脂肪酸の組成比に近く、照射されたと明確に判定できた。
電子線照射については日本照射サービスにご協力を頂いた。ここに記して、感謝致します。
1) 後藤典子, 田辺寛子, 宮原 誠 : 食品照射, 35, 23-34 (2000).
2) European Committee for Standardization : Foodstuffs- Detection of irradiated food containing fat- Gas chromatographic analysis of hydrocarbons, BS EN 1784 (1996).
3) W. W. Nawar : Food Reviews International, 2(1), 45-78 (1986).
4) T. Tabata, P. Andreo, K. Shinoda : Radiat. Phys. Chem., 53, 205-215 (1998).
5) A. Spiegelberg, G. Schulzki, N. Helle, K. W. Boegl and G. A. Schreiber : Radiat. Phys. Chem., 43, 433-44 4 (1994).
6) G. A. Schreiber, G. Schulzki, A. Spiegelberg, N. Helle and K. W. Boegl : Journal of AOAC international, 77, 1202 (1994).
7) 科学技術庁資源調査会編 日本食品脂溶性成分表 大蔵省印刷局出版 90-101 (1998).
(2001 年 6 月 28 日受理)
 |
 |
 |
 |
 |
 |
 |
 |
 |
 |
|
|