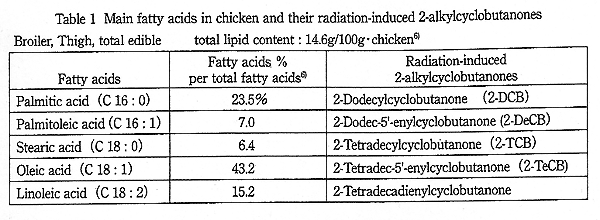
Table 1. Main fatty acids in chicken and their radiation-induced 2-alkylcyclobutanones.
 |
2.3 試薬
2.3.1 一般試薬
2.3.2 標準物質
2.3.3 フロリジル
2.5 測定方法
2.5.1 脂肪の抽出
2.5.2 脂肪含量の測定
2.5.3 フロリジルカラムクロマトグラフィ
2.5.4 GC/MS 測定条件
2.5.5 検量線
殺菌等のために照射された食品の検知法は、1980 年代後半より各国で研究されてきた。脂肪の放射線分解に関しては、1970 年代以前より分解生成物の研究が行われており、この成果を脂肪を含む食品の検知法に応用することが提唱され、研究所間のブラインド試験が行われた。そして、1996 年 European Committee for Standardization の標準法 (EN 標準法) として、脂肪を含む食品の炭化水素をガスクロマトグラフィ (GC) によって検出する方法1)、および 2- アルキルシクロブタノン (2-RCB) をガスクロマトグラフィ・質量分析計 (GC/MS) で検出する方法2) が採用された。
脂肪は放射線照射によって分解し、いろいろな炭化水素を生成する。このうちトリグリセリド中のアシル基−酸素結合が開裂すると、元の脂肪酸と同じ炭素原子数の 2-RCB が生成する3)。これを GC/MS で検出する方法が EN 標準法である。この 2-RCB は、脂肪の放射線分解によって同様にできる一部の炭化水素とは異なって、放射線特異分解物である2)。また 2-RCB の検出限界や安定性は調理や貯蔵によっても大きな影響を受けないと報告されている4), 5)。
EN 標準法では palmitic acid と stearic acid から生成する 2-dodecylcyclobutanone (2-DCB) と 2-tetradecylcyclobutanone (2-TCB) を検出することとなっている。しかし多くの食品中の脂肪では、構成脂肪酸として oleic acid が多く存在する。また、鶏肉には palmitoleic acid も stearic acid と同程度含まれている (Table 1)。そこでこれらの脂肪酸より分解生成する、2-tetradec-5'-enylcyclobutanone (2-TeCB) および 2-dodec-5'-enylcyclobutanone (2-DeCB) についても検討したので報告する。
試料は、市販国産皮付き若鶏もも肉を用いた。
皮付き若鶏もも肉を 2cm 程度にカットし、ガラス試料管に入れ、当研究所のコバルト−60 (60Co) 線源 (185TBq) を用いて、線量率 0.5 〜 4kGy/h、室温でγ線照射を行った。
照射 5 日後に、鶏肉約 15g を粗くきざみ、無水硫酸ナトリウム約 15g とよく混合し、セルロース抽出筒に入れた。これをソックスレー抽出器にセットし、約 140ml の n-hexane で約 6 時間還流させ、油脂分を抽出した。この n-hexane 抽出液を 100ml にメスアップし、無水硫酸ナトリウム 10g を加え、撹拌後一晩放置した。
重量既知の蒸発皿に、2.5.1 で抽出した n-hexane 溶液を一定量入れ、蒸発させ秤量し、200mg の脂肪に相当する n-hexane 抽出溶液の体積を計算した。
不活性化処理をしたフロリジルをつめたクロマト管に、脂肪 200mg 相当の濃縮した n-hexane 抽出溶液を加えた。n-hexane 150ml を約 2ml/min の流速で流し、次に 1% diethyl ether を添加した n-hexane 混合物を同様に流下させた。120ml までの溶出分を分析対象とし、ロータリーエバポレータを用い、40℃ 25kPa で約 2ml までに濃縮した。EN 標準法では、このフロリジルカラムでの精製分離の際、150ml の 1% diethyl ether/n-hexane で溶出させることになっているが、溶離液量が多くなるほど油脂が溶出してくる。そのため溶離液を 30ml のフラクションにわけ、各フラクションでの 2-RCB と油脂の溶出状況を調べ、120 〜 150ml のフラクションには 2-RCB が溶出しないことを確認した。
次にこの約 2ml 濃縮物を窒素気流中室温で 0.2ml までさらに濃縮し、これに 0.5μg/ml の 2-cyclohexylcyclohexanone/n-hexane 内部標準溶液を 0.2ml 加え、GC/MS 測定試料とした。EN 標準法では、40℃ でロータリーエバポレータを用いて濃縮した溶出液の n-hexane を 40℃ 窒素気流中で蒸発させている。この時蒸発後は試料を窒素気流下に放置しないようにしているが、この操作は回収率に影響を与え、注意が必要であった。
GC 用カラム : J&W 製キャピラリーカラム DB5 (内径 0.2mm、膜厚 0.33μm、長さ約 12m)
注入口温度 : 230℃、オーブン温度 : 55℃ で 2 分保持し、155℃ まで 10℃/min、200℃ まで 4℃/min、270℃ まで 15℃/min で昇温。イオン源温度 : 270℃。キャリアガス : ヘリウム (1ml/min コンスタントフローモード)、試料注入量 : 1.0μl、スプリットレス。イオン化法 : EI。イオン化電圧 : 70eV。検出器 : MSD (スキャンレンジ : m/z45 〜 550)。取り込みモード : SCAN、SIM。
上記の条件で試料を測定し、GC/MS のクロマトグラムを標準物質の保持時間、分子イオンピーク、フラグメントイオンと比較し、それぞれの 2-RCB を同定した。m/z98、m/z112 のフラグメントイオンを用いて SIM 測定を行い、m/z98 のイオンピーク強度を用いて定量した。
0.5μg/ml の 2-cyclohexylcyclohexanone/n-hexane 溶液 0.2ml と 0.25、0.5、1.0、2.0μg/ml の 2-RCB の標準溶液 0.2ml を使って検量線を作成し定量した。検量線の相関係数の R2 は 2-DCB : 0.997、2-TCB : 0.985、2-TeCB : 0.988、2-DeCB : 0.872であった。m/z98 のイオンの定量下限は S/N 比 : 10、確認限界は S/N 比 : 3 とした。
EN 標準法では、照射済みの判定の条件は、少なくとも一つの 2-RCB が同定されること。この同定の判定基準は (m/z98)/(m/z112) 比が 2-DCB で 4.0 〜 4.5 の範囲、2-TCB で 3.8 〜 4.2 の範囲にあることである。そして最も小さい感度の 2-RCB のピーク面積がノイズの 3 倍以上であることである。
測定したうち最も濃度が薄い 0.25μg/ml の標準溶液では、これらのピークの S/N 比は明らかに 3 倍以上あった。2-DCB の (m/z98)/(m/z112) 比は、同定とされる範囲内にあったが、しかし 2-TCB では、(m/z98)/(m/z112) 比は同定とされる範囲内になかった。
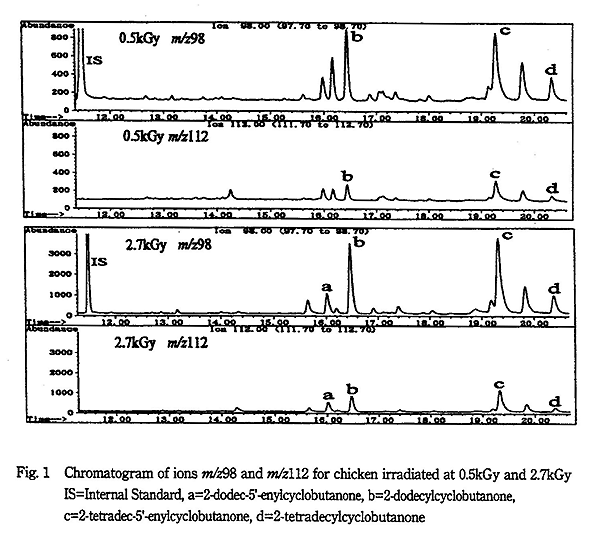
Fig. 1 に 0.5kGy と 2.7kGy 照射鶏肉の m/z98 と m/z112 のクロマトグラムを示す。このように SCAN モードに比べ、SIM モードではきれいなクロマトグラムが得られ、妨害が少ないことが判明した。
実際の試料では 0.5kGy の線量で 2-DCB のみ、同定とされる (m/z98)/(m/z112) 比が 4.0 〜 4.5 の範囲に入った。そして 0.12μg/g・fat の 2-DCB が検出された。2-TCB のピーク面積は明らかにノイズの 3 倍以上であった。これは、EN 標準法の照射済みという判定の条件に一致した。
また、2.7kGy 照射では、2-DCB は 1.0μg/g・fat、2-TCB は 0.35μg/g・fat 検出された。FAO/IAEA 研究所間ブラインド試験7) の結果では、平均 3kGy の照射で 2-DCB は 0.699μg/g・lipid、2-TCB は 0.265μg/g・lipid であった。この濃度の差は、照射条件や試料の違いによるものと考えられる。
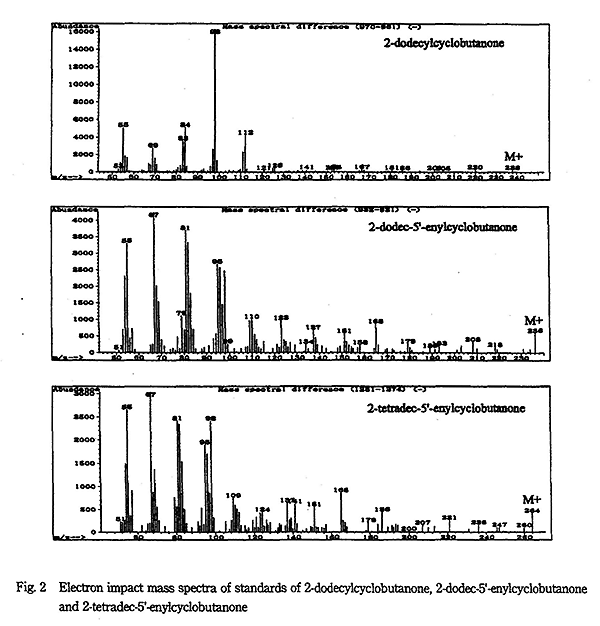
Fig. 2 に 2-DCB、2-DeCB 及び 2-TeCB のフラグメントイオンのパターンを示した。2-DCB や 2-TCB では特に m/z98 のイオンが他のフラグメントイオン強度より数倍大きい。一方 2-DeCB、2-TeCB のフラグメントイオンパターンは 2-DCB や 2-TCB とはかなり異なり、m/z が 98 以下のフラグメントイオンが多く生成する。2-DeCB と 2-TeCB を合成した M. Miesch ら8) はイオン m/z95 のみでモニターしている。2-TeCB では H-J.Lee ら9) は m/z67、m/z81、m/z98、m/z109 を選択イオンとしている。2-DeCB と 2-TeCB では、このように多くのフラグメントイオンが生成し、トータルイオンクロマトグラムとして強度はあっても、特に強い特徴的フラグメントイオンがない。そのため、感度が悪くなっている。定量のためにどのフラグメントイオンを選択するか検討の必要がある。
2-TeCB の感度は低いが、oleic acid は、脂質を多く含有する食品中に、他の脂肪酸と比較しても量的にも多く見られるので、m/z98 のフラグメントイオンのピーク面積で定量を行った。その結果 0.5kGy の線量で、0.57μg/g・fat の 2-TeCB を検出した。
一方 2-DeCB は検量線の直線性も悪く、相関係数 R2 は 0.872 であった。2.7kGy で照射された試料からは、0.7μg/g・fat が検出された。
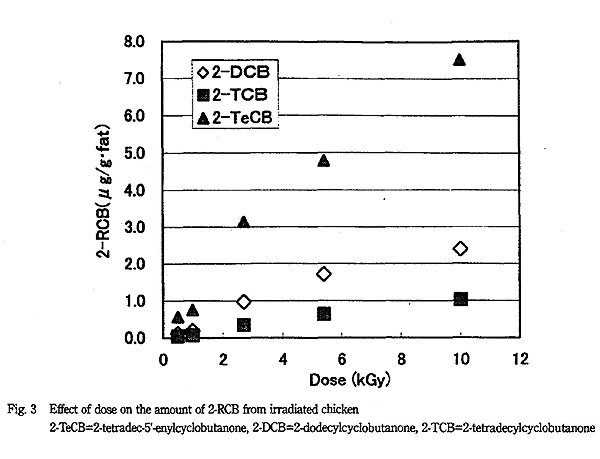
Fig. 3 に鶏肉に照射した線量とこれらの 2-RCB の生成量の関係を示した。このように照射の線量が増えるとともに 2-RCB の生成量は増加した。また 2-RCB の生成量は、元の脂肪酸の含有量に従い、 2-TeCB > 2-DCB > 2-TCB の順であった。一方未照射鶏肉からはどの 2-RCB も検出されなかった。
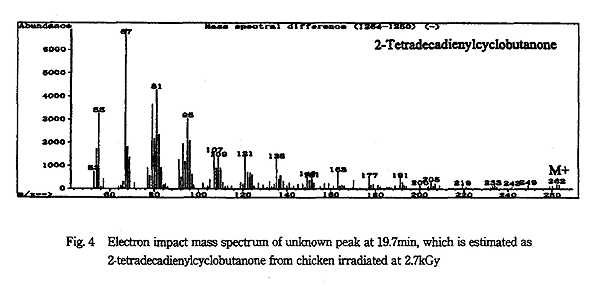
2.7kGy 照射鶏肉からの試料を SCAN モードで測定すると、2-TeCB のピークに隣接する位置 (R.T. : 19.6min) に未知物質のピークが検出された。そのマススペクトラムを Fig. 4 に示す。鶏肉には linoleic acid も脂肪酸総量のうち約 15.2%6) 含まれている。A.V.J.Crone ら10) は trilinolein の放射線分解により生成した、2-tetradecadienylcyclobutanone を検出している。このマススペクトラムと比較した結果、主なフラグメントイオンが一致し、このピークは linoleic acid から分解生成する 2-tetradecadienylcyclobutanone であると思われる。標準物質が入手できれば、食品によってはこの 2-tetradecadienylcyclobutanone も照射の検知に使用できると考えられる。
照射された鶏肉から脂肪を抽出し、フロリジルカラムにより精製、その濃縮溶離物から palmitic acid 由来の 2-dodecylcyclobutanone (2-DCB) と stearic acid 由来の 2-tetradecylcyclobutanone (2-TCB) を GC/MS で検出する方法において、0.5kGy 以上の照射を判定できることが確認できた。多くの食品中の脂肪にはその構成脂肪酸として oleic acid が多く存在する。また、鶏肉には palmitoleic acid も stearic acid と同程度含まれている。この oleic acid、palmitoleic acid から放射線分解生成する、2-tetradec-5'-enylcyclobutanone (2-TeCB) 及び 2-dodec-5'-enylcyclobutanone (2-DeCB) についても、同様の分析方法で検出することができた。これらの 2-TeCB、2-DeCB は感度は低いが、照射鶏肉においては、2-TeCB は 0.5kGy の線量で 0.57μg/g・fat 検出され、照射の検知に利用できる。一方 2-DeCB は検出限界線量は高かったが、食品中の脂肪酸の成分量によっては照射検知の指標となりうることが明らかになった。また linoleic acid から分解生成する 2-tetradecadienylcyclobutanone も他の 2-alkylcyclobutanone と同時に検出された。
1) European Committee for Standardization : Foodstuffs−Detection of irradiated food containing fat−Gas chromatographic analysis of hydrocarbons, EN1784 (1996).
2) European Committee for Standardization : Foodstuffs−Detection of irradiated food Containing fat−Gas chromatographic /mass Spectrometric analysis of 2-alkylcyclobutanones, EN1785 (1996).
3) P. R. LeTellier and W. W. Nawar : Lipids, 7, 75-76 (1972).
4) A. V. J. Crone, J. T. G. Hamilton and M. H. Stevenson : J. Sci. Food Agric., 58, 249-252 (1992).
5) A. V. J. Crone, J. T. G. Hamilton and M. H. Stevenson : J. Food Sci. Technol., 27, 691-696 (1992).
6) 科学技術庁資源調査会編 : 日本食品脂溶性成分表, 大蔵省印刷局, 104 (1998).
7) M. H. Stevenson : Detection methods for irradiated foods. Current status. The Royal Society of Chemistry, Cambridge, 269-284 (1996)
8) M. Miesch, B. Ndiaye, C. Hasselmann and E Marchioni : Radiat. Phys. Chem., 55, 337-344 (1999).
9) H-J. Lee, M-W. Byun and K-S. Kim : J. Food Prot., 63, 1565-1569 (2000).
10) A. V. J. Crone, M. V. Hand, J. T. G. Hamilton, N. D. Sharma, D. R. Boyd and M. H. Stevenson : J. Sci. Food Agric., 62, 361-367 (1993).
(2001 年 6 月 11 日受理)
 |
 |
 |
 |
 |
|
|