Fig. 1 Alkaline comet assay of cherry seed embryos.
 |
実験方法
1. 試料及び照射
2. DNA コメットアッセイ
3. ハーフエンブリオテスト
実験結果及び考察
1. コメットアッセイによるサクランボ胚の DNA 損傷の観察
2. ガンマ線照射の発芽に及ぼす影響
検疫処理や土壌消毒に用いられている臭化メチルは、オゾン層破壊物質であるとしてその使用が 2005 年を期限に全廃されることが決定している。放射線照射は、検疫処理における臭化メチル燻蒸の代替処理として有望視されており、種々の農産物における検疫対象害虫に対する有効な放射線の線量の検討が行われている1)。
検疫処理に放射線照射を導入するためには、その適正な流通を管理するために、果実や農産物を対象にした低線量の照射の有無を検出する検知技術の確立が望まれる。これまでに、河村らは、果実種子の発芽能力を迅速簡便に測定する、ハーフエンブリオテスト法を開発して、柑橘類2) やリンゴ及びサクランボ3) の検知に応用し、また、この方法の有効性を複数試験機関におけるブラインドテストを使って検証している4)。
DNA コッメトアッセイは、放射線などによって起こる DNA の損傷を検出する技術で、照射食品の簡便なスクリーニング法として動物性食品や植物種子に応用されている5) 〜 9)。この方法は、放射線による DNA 損傷 (鎖切断) を高感度に検出できるため、原理的には、DNA を含む動植物食品に対して広範に応用できる可能性を有している。
現在、日本国内に輸入されている果実の中で、検疫における消毒法に臭化メチル燻蒸が 100% 採用されているものの一つとして、カナダ、アメリカ、ニュージーランド産のサクランボがある。サクランボの検疫対象害虫のコドリンガの消毒に有効なガンマ線の線量は 140Gy と報告されており10)、サクランボ種子のハーフエンブリオテストの検出限界は、150Gy と報告されていることから、この方法は、サクランボに対する実用的な照射の検出に対応できるものと判断される。しかし、判定に要する時間が 4 日と長いため、より短期間で判定のできる方法の開発が望まれる。
本研究では、検疫に要する線量を想定して、サクランボ果実を 100Gy-200Gy 照射し、種子胚の細胞 DNA の損傷をコメットアッセイにより測定した。同時にハーフエンブリオテストを実施して両者の比較を行い、検知技術としての可能性を議論すると同時に、ガンマ線照射による発芽能力の欠損と DNA 鎖切断及び修復能との関係について考察した。
サクランボ (アメリカ産) は市販のものを用いた。果実の照射は、ガンマセル 220 (線量率 1.5kGy/h) を用い、100、150 および 200Gy の線量で常温にて行った。 照射後の果実は 5℃ の冷蔵庫に保存した。
サクランボの種子の外種皮を破砕、内種皮を取り除いた後に胚を取り出した。これに液体窒素を加えて急冷し、凍結状態の胚を乳鉢で粉砕した。胚 1 個につき 2ml の 25mM EDTA を含む PBS 緩衝液中を加え、氷中で 5 分攪拌し、50μm のナイロンメッシュでろ過し、5 分間静置した上清から核断片を集めた。この試料について、Sigh らの11) 方法に基づいて、アルカリ条件でコメットアッセイを行った。すなわち、核断片を 10 倍量の 0.5% の低融点アガロースと混合した後、スライドグラス上に固定した。これを、2.5M NaCl、1% サルコシルナトリウム、100mM EDTA 10mM Tris (pH=10.0) 1% Triton X-100、 10% DMSO からなる lysis 溶液につけ 1 時間 5℃ で放置し、タンパク質を溶解した。サブマリン電気泳動槽に 300mM NaOH 1mM EDTA (pH>13) を満たし、細胞を固定したスライドグラスを並べ、20 分間放置して、unwinding を行ったのち、0.75V/cm の条件で 15 分間泳動した。
コメット像は 20μg/ml のヨウ化プロピルで 3 分間染色したのち、2 分間水洗し、蛍光顕微鏡 (OLYMPUS BX50) で観察した。無作為に視野を選んで、1 サンプルあたり 20 個以上のコメット像を、CCD カメラ (MITSUBISHI CIT605) を用いて撮影し、コンピュータ画像として保存した。コメット画像の解析は画像解析ソフト (ユーワークス製、http://www.youworks.co.jp/) を用いて行い、Tail Moment を計算した。
河村らの方法3) に従って行った。ガンマ線照射後 13 日間冷蔵保存した果実から、コメットアッセイの時と同様に胚を得た。これの胚の子葉を 1 枚除去してハーフエンブリオを調製した。各処理区 10 個のハーフエンブリオをシャーレ中の 10μM ベンジルアデニン溶液を浸した脱脂綿上に置き、ふたをして暗所において 25℃ で培養し、発芽及び発根の様子を観測した。
照射直後にサクランボ種子の胚から核断片を調製し、アルカリ条件でコメットアッセイを行うと、照射サンプルでは、DNA 鎖切断に由来する長く尾を引いた形のコメット像が観測された。また、非照射のサンプルでは、ほぼ球形の泳動像が観測され、DNA 鎖の切断はほとんど観測されなかった。また、果実の貯蔵による影響を検討したところ、照射 36 時間後には、照射サンプルのコメット像の Tail が短くなるのが観察され、72 時間後には、200Gy においても損傷による Tail がほとんど検出されず、非照射と同様の球形の泳動像が観測された (Fig. 1)。
画像解析装置を用いて、損傷の指標である Tail Moment (DNA の移動度と損傷部の蛍光強度のコメット全体の蛍光に対する比率の積算) を計算し、貯蔵中の変化を追跡した結果を Fig. 2 に示す。照射直後は、どの線量においても、非照射のコントロールに比べて Tail Moment の有意な増加が見られたが、72 時間後には、200Gy 照射のサンプルでもコントロールとの差は無くなった。
アルカリ条件のコメットアッセイでは、DNA に生じた 1 本鎖切断と 2 本鎖切断の両方を検出している。照射直後には、これらの DNA 鎖切断に由来する損傷の大きいコメット像が観察されたが、照射後の貯蔵中に鎖切断の修復が行われ、36 時間後には Tail の長さが短くなり 72 時間後には、鎖切断は修復されたと考えられる。完熟した乾燥種子においては、DNA 損傷の修復は、吸水後発芽時に起こると報告されており12), 13)、Koppenn らは、ダイス、ひまわり種子など数種の乾燥状態の植物種子について、中性のコメットアッセイを用いて、照射の有無を 0.1kGy まで検出できると報告している6)。また、Barros らも小麦について 6 ヶ月間の貯蔵期間を経ても 0.1kGy の照射の履歴をコメットアッセイによって検出できると報告している8)。しかし、今回我々が行った、サクランボ果実中の乾燥していない種子胚では、修復速度が速く、200Gy の照射でも流通期間における照射の有無の検出にコメットアッセイを用いることは、難しいと判断された。
 |
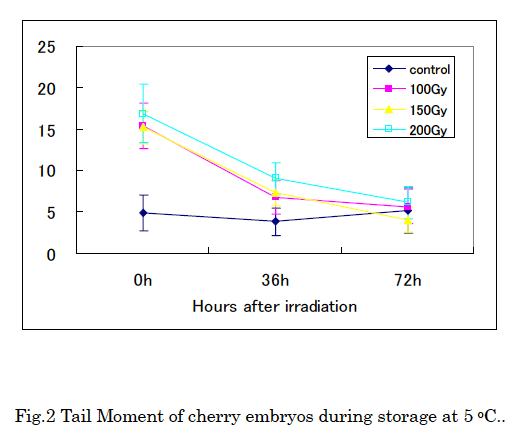 |
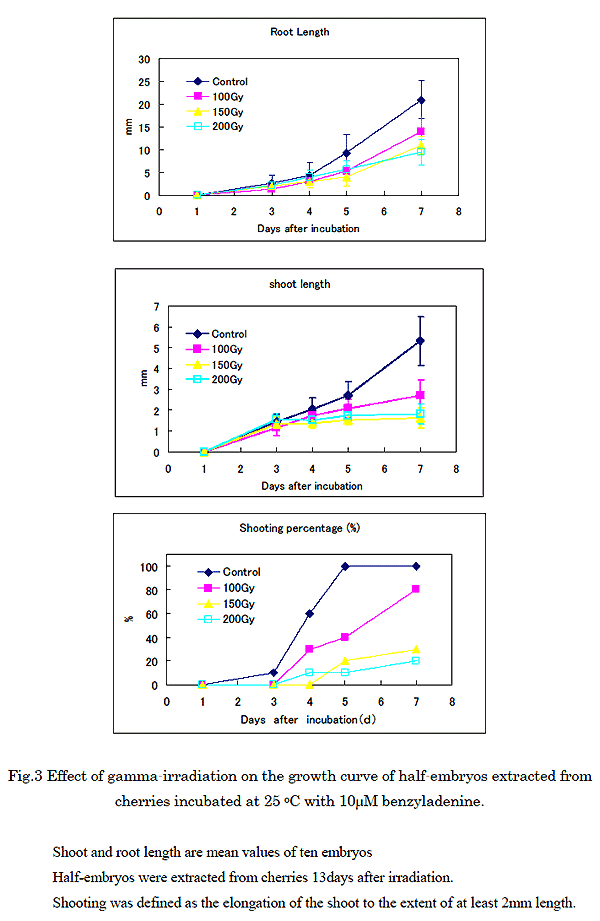
Fig. 3 に照射したサクランボ果実を 13 日間、冷蔵した後ハーフエンブリオテストを調製し、25℃ で培養した時の芽と根の長さを測定した結果を示す。また、Fig. 4 に培養 5 日後のハーフエンブリオの写真を示す。培養 3 日後には、いずれの処理区においても、わずかな発根、発芽が認められ、非照射のコントロールでは、培養日数の経過とともに、芽、根ともに伸長が認められた。一方、ガンマ線処理を行った果実から抽出した種子では、根及び芽の伸長が線量に応じて遅れるのが認められた。特に、照射区における発芽の遅れは顕著で、150Gy 以上の照射では、培養 7 日後でも、芽の長さの平均値が 2mm を越えることが無かった。河村らは、サクランボにおけるハーフエンブリオ試験の方法として、芽の長さ 1mm 以上を発芽と定義して、10 個体以上のハーフエンブリオの発芽率が培養 4 日後に 50% に達しないものを照射と判定すると報告している4)。しかし、本実験では、照射区においても、培養 3 日後からわずかではあるが芽の伸長が認められたため、発芽の定義を芽の長さが 2mm 以上に達したものとし、発芽率の経日的変化をグラフに示した。非照射のコントロールでは、培養 4 日後に発芽率が 60%、5 日後には 100% に達した。一方、100Gy 照射では、培養 5 日後でも発芽率が 50% を越えず、7 日後になって、80% に到達した。150Gy 以上の照射では、培養 7 日後になっても、発芽率は 20% 以下と低いままであった。以上から照射後の貯蔵に関わらず、培養 4 日後の発芽率、50% を基準とし、100Gy を限界として照射の有無の判別が可能であった。
これらの結果から、コメットアッセイで検出可能な DNA 鎖の切断が貯蔵期間中に修復されても、発芽能力は回復せず、検疫処理を想定した低線量のガンマ線照射の有無の検出が、発芽試験 (ハーフエンブリオ) 試験で可能あると結論された。
 |
 |
1) G. J. Hallman : in Food Irradiation: Principles and Applications, Ed by R. A. Molis (John Wiley & Sons Inc.) pp.113-130.
2) Y. Kawamura, S. Uchiyama, Y. Saito : J Food Sci., 54 (6), 1501-1504(1989).
3) Y. Kawamura, A. Miura, T. Sugita, T. Yamada, Y. Saito : Radiat. Phys. Chem, 46 (3), 371−375 (1995).
4) Y. Kawamura, T. Sugita, T. Yamada, Y. Saito : Radiat. Phys. Chem., 48 (5), 665-668 (1996).
5) H. Cerda, H. Delincee, H. Haine, H. Rupp : Mutation Research : 375, 167-181 (1997).
6) G. Koppen, H. Cerda : Lebensm.-Wiss.u.-Technol., 30, 452-457 (1997).
7) A. A. Khan, H. M. Khan, H. Delincee : J Food Sci., 67 (2), 493-496 (2002).
8) A. C. Barros, M. T. L. Freund, A. L. C. H. Villavicencio, H. Delincee, V. Arthur : Radiat. Phys. Chem., 63, 423-426 (2002).
9) European Committee for Standardization EN 13784 (2001).
10) IAEA : IDIDASデータベース http://www-ididas.iaea.org/IDIDAS/start.htm
11) Singh, N. P., McCoy, M. T., Tice, R. R., Schneider, E. L., Experimental Cell Research 175, 184 (1988).
12) R. H. Elder et. al : Mutat Res. 181, 61-71 (1987).
13) R. H. Elder and D. J. Osborne : Seed Sci. Res. 3, 43-53 (1993).
(2002 年 8 月 2 日受理)
|
|